Avant-propos
Table des matières
Chapitre
1 : Généralités sur la Thermodynamique
1. Physique des milieux continus et Physique des particules
2. Systèmes. Variables d’état. Etat d’équilibre. Equations
d’état.
3. Transformations d’un système
Chapitre
2 : La variable d'état Pression
1. Pression dans un fluide au repos (en équilibre dans un référentiel
galiléen)
1.1. Etude expérimentale dans le champ de pesanteur
1.2. Définition de la pression dans un fluide
1.3. Remarque
1.4. Relation locale traduisant l’équilibre d’un fluide dans un référentiel
galiléen
2. Cas d’un fluide au repos dans un référentiel galiléen
soumis au champ de pesanteur. Principe de l’hydrostatique.
2.1. Surface de séparation entre deux fluides non miscibles au repos
2.2. Fluide incompressible (liquide)
2.3. Fluide compressible (gaz)
Exercices
sur la mesure des pressions dans les fluides
Chapitre
3 : La variable d'état Température
1. Principe de Thermométrie (ou Principe 0 de la Thermodynamique)
2. Echelles de température. Echelle légale
2.1. Thermométrie et grandeur thermométrique
2.2. Faits expérimentaux
2.3. Echelle légale de température
2.4. Autres échelles de température
3. La mesure des températures
3.1. Points fixes fondamentaux
3.2. Les thermomètres
3.3. Thermométrie
Chapitre
4 : Structure de la matière
1. Introduction : gaz, liquide, solide
2. L’hypothèse atomique (ou moléculaire)
3. Les deux états de la matière : l'état désordonné
et l'état ordonné
3.1. Les états désordonnés
3.1.1. Le Gaz
3.1.1.1. Agitation au niveau microscopique
3.1.1.2. Interprétation microscopique de la pression
3.1.1.3. Mélange idéal de gaz parfaits
3.1.1.4. Facteur de Boltzmann. Raréfaction de l'air
3.1.1.5. Température cinétique. Equipartition de l'énergie.
Energie d’un gaz parfait
3.1.2. Le liquide
3.1.3. Le solide amorphe
3.2. L'état ordonné : le solide cristallisé
4. Changements de phases (d’état) des corps purs
4.1. Introduction
4.2. Observation courante
4.3. Equilibre liquide-vapeur
4.4. Equilibre liquide-solide, équilibre solide-gaz
4.5. Remarque
Quiz
: pression, structure de la matière
Tests
d'apprentissage : pression, température, interprétations microscopiques,
équipartition de l'énergie
Chapitre
5 : Détermination expérimentale des équations d'état
Exercices
sur les équations d'état
Tests
d'apprentissage : équation d'état
Chapitre
6 : Le premier principe
1. Notion de conservation de l’énergie
2. Premier Principe de la Thermodynamique
2.1. Modification de l’état d’un système
2.2. Principe d’équivalence
2.3. Energie interne
2.4. Premier Principe de la Thermodynamique pour un système fermé
3. Mécanique et Thermodynamique. Principe de conservation de l’énergie
Annexe : quelques rappels simples de Mécanique
Chapitre
7 : Le second principe
1. Le Second Principe pour un système fermé
1.1. Enoncé
1.2. Entropie d’un système isolé fermé
1.3. Remarques
1.4. Conséquences mathématiques des premier et second principes
2. Les énoncés historiques de Clausius et Thomson
2.1. Enoncé de Clausius
2.2. Enoncé de Thomson (Lord Kelvin)
3. Les causes d’irréversibilité
Chapitre
8 : Détermination des fonctions d'état associées à
un système homogène, sous une phase, en équilibre
1. Variables intensives et extensives
2. Travail des forces de pression extérieure
3. Expressions de la quantité de chaleur dQ
; coefficients calorimétriques
3.1. Relations entre les coefficients calorimétriques
3.2. Conséquences mathématiques des premier et second principes
3.3. Détermination des fonctions d’état U, H et
S
3.4. Exemple de calcul des fonctions d'état U, H
et S : le gaz parfait
4. Mesure des capacités calorifiques
4.1. Méthodes de mesure pour les solides, les liquides
4.2. Méthodes de mesure pour les gaz
4.3. Résultats
Exercices
sur les fonctions d'état
Tests
d'apprentissage : connaissances de base en Thermodynamique
Exercices
sur les gaz parfaits
Quiz : gaz parfaits
Transformation isotherme réversible
Transformation isotherme irréversible
Transformation isochore réversible
Transformation isochore irréversible
Transformation isobare réversible
Transformation isobare irréversible
Transformation adiabatique réversible
Transformation adiabatique irréversible
Exercices
sur les corps réels
Chapitre
9 : Etude thermodynamique des changements de phases des corps purs
1. Définition de la chaleur latente de changement de phase (d’état)
d’un corps pur
2. Etude énergétique
2.1. Définition du titre. Règle du levier.
2.2. Relations de Clapeyron
3. Etablissement des bases de données sur les fonctions d'état
4. Mesure des chaleurs latentes
4.1. Dispositifs expérimentaux
4.2. Résultats
Exercices
sur les changements de phases
Chapitre
10 : Considérations sur les machines thermiques
1. Considérations théoriques sur les machines dithermes
1.1. Les moteurs
1.2. Les appareils frigorifiques et les pompes à chaleur
2. L’énergie dans le monde contemporain
2.1. Les sources d’énergie
2.2. Bilan énergétique
2.3. Les limites du Professeur de Science
3. Quelques données techniques sur la réalisation des machines
3.1. Le moteur à vapeur d’eau fonctionnant suivant un cycle de Carnot
3.2. Appareil frigorifique - ou pompe à chaleur - fonctionnant suivant
un cycle de Carnot
3.3. Les moteurs à combustion interne
Exercices
sur les machines thermiques
Quiz : Machines thermiques
Moteurs thermiques
Locomotive à vapeur
Turbine à vapeur
Moteur à combustion
Machine frigorifique
Tests
d'apprentissage : machines thermiques
Annexe : Outils
de calcul pour Sciences Physiques
0. Calcul des dérivées
1. Développements en série de puissance
2. Calcul des expressions indéterminées
3. Calcul différentiel
4. Différentielles d’ordre supérieur
5. Différentielles des fonctions de plusieurs variables indépendantes
6. Calcul intégral
7. Equations différentielles
8. Les différents repères
9. Eléments d'analyse vectorielle
10. Analyse de Fourier
Annexe
: Méthodes d'intégration
1. Primitives usuelles
2. Méthodes d'intégration
2.1. Méthode immédiate
2.2. Intégration par changement de variable
2.3. Intégration par parties
3. Intégration des fonctions trigonométriques
3.1. Méthode générale
3.2. Autres méthodes
4. Intégration des fonctions rationnelles de exp(ax)
Annexe
: la loi de distribution des vitesses de Maxwell
1. Fonction de distribution du vecteur vitesse
2. Fonction de distribution du module de vitesse
3. Calcul d’une valeur moyenne
4. Retour sur la loi de distribution des vitesses
5. Pression d’un gaz parfait
6. Le facteur de Boltzmann
Intégrales 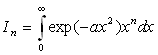
Annexe
: les particules de base de la matière
1. L’hypothèse atomique (ou moléculaire)
2. La particule de base
2.1. L'atome
2.2. Les particules de base
Annexe
: Statique des fluides
1. Pression dans un fluide au repos (en équilibre dans un référentiel
galiléen)
1.1. Etude expérimentale dans le champ de pesanteur
1.2. Définition de la pression dans un fluide
1.3. Relation locale traduisant l’équilibre d’un fluide dans un référentiel
galiléen
2. Cas d’un fluide au repos dans le champ de pesanteur
2.1. Surface de séparation entre deux fluides non miscibles au repos
2.2. Fluide incompressible (liquide)
2.3. Fluide compressible (gaz)
2.4. Théorème d’Archimède et corps flottants
3. Relation locale traduisant l’équilibre d’un fluide dans un référentiel
non galiléen
4. Phénomènes de tension superficielle
4.1. Tension superficielle
4.2. Loi de Laplace
4.3. Capillarité. Loi de Jurin
4.4. Mesure des tensions superficielles
Exercices-type