CHAPITRE 1 : Généralités sur la Thermodynamique. Statique des fluides. Thermométrie. Gaz parfait.
Plan
1. Physique des milieux continus et Thermodynamique
1.1. Systèmes. Variables d’état. Etat d’équilibre.
Equations d’état
1.2. Transformations d’un système
2. Statique des fluides
2.1. Pression dans un fluide au repos
2.2. Cas d’un fluide au repos dans un champ de pesanteur
2.3. Relation locale dans un référentiel non
galiléen
2.4. Phénomènes de tension superficielle
3. Température et équation d’état des gaz
parfaits
3.1. Principe de Thermométrie
3.2. Echelles de température. Echelle légale
3.3. La mesure des températures
4. Applications simples de l’équation d’état des
gaz parfaits
4.1. Un gaz parfait obéit aux lois de Gay-Lussac et
de Charles
4.2. Un gaz qui obéit aux lois de Gay-Lussac et de Charles
est un gaz parfait
4.3. Mélange idéal de gaz parfaits
4.4. Autre écriture de l’équation d’état
des gaz parfaits
4.5. Masse volumique et densité des gaz parfaits
1. Physique des milieux continus et Thermodynamique
Parce que l’enseignement des notions d’atomistique est largement
développé, chacun est convaincu du caractère discontinu
de la matière. Pourtant à l’échelle macroscopique
courante, la matière nous parait continue. Ces deux façons
d’appréhender la matière sont complémentaires, se
nourrissent l’une de l’autre tout au long de l’enseignement des Sciences
Physiques.
Les deux premiers chapitres de ce cours seront consacrés
à l’étude de modèles simples qui nous permettent de
rendre compte scientifiquement de la matière.
La Physique ne s’est pas faite en un jour, elle est le résultat
de tâtonnements successifs, un cours (surtout celui que nous allons
faire dans ces deux chapitres) n’est jamais linéaire. Il arrive
souvent que l’on soit amené à faire appel au sens commun
pour présenter une notion, un modèle qui, de fait, nous sert
à définir, à qualifier, à quantifier le phénomène
…donc à le comprendre.
Macroscopiquement aussi petit soit-il, un échantillon de matière,
en Physique des milieux continus, contient un grand nombre de particules - 3
cm3 d’eau renferme ![]() molécules - . L’hypothèse de milieu continu considère que
la matière occupe continûment tout le volume. Ainsi si un échantillon
de volume dV contient des particules, la masse dm de l’échantillon
sera la somme des masses des particules et, en Physique des milieux continus,
on définit la masse volumique
molécules - . L’hypothèse de milieu continu considère que
la matière occupe continûment tout le volume. Ainsi si un échantillon
de volume dV contient des particules, la masse dm de l’échantillon
sera la somme des masses des particules et, en Physique des milieux continus,
on définit la masse volumique ![]() qui a donc un caractère de valeur moyenne.
qui a donc un caractère de valeur moyenne.
1.1. Systèmes. Variables d’état. Etat d’équilibre. Equations d’état.
Nous appelons système un ensemble constitué d’un
grand nombre de particules. Tout système sera en interaction avec
d’autres systèmes de l’Univers qui constituent le
milieu extérieur.
L’interaction se traduit par des échanges de matière
et des échanges d’énergie sous forme de travail et de chaleur.
Système et milieu extérieur peuvent ne pas présenter
de différences de nature, mais l’observateur les différencie
par le rôle qu’il leur fait jouer, les frontières les séparant
pouvant être réelles ou fictives.
Un système est fermé s’il ne peut échanger
de la matière avec l’extérieur, dans le cas inverse il est
ouvert.
Un système fermé est isolé s’il n’échange
aucune énergie avec l’extérieur, il n’est pas isolé
s’il échange de l’énergie.
En Physique des milieux continus, on décrit l’état d’un
système par l’introduction d’un nombre restreint de paramètres
mesurables qui rendent compte de l’état du système. On
les appelle variables d’état.
C’est l’expérience qui est déterminante pour définir
les variables d’état nécessaires.
La température, la pression, le volume
et la quantité de matière sont les variables d’état
les plus couramment nécessaires. Ce ne sont pas les seules mais,
sauf cas très exceptionnel, nous n’envisagerons que ces seules variables
d’état dans le cadre de ce cours où on s’intéresse
principalement aux fluides et en particulier aux gaz.
Un système est en état d’équilibre si les
variables d’état du système sont constantes (dans le temps)
et uniformes dans toute partie homogène du système.
Pour mieux comprendre : Soit le mur extérieur d’une maison
chauffée. Sa température varie d’un endroit à un autre
du mur, de la température intérieure à celle extérieure.
Le système " mur " est en état de déséquilibre
même si, en chaque endroit, la température est constante.
Dans ce dernier cas, on dira que le mur est en régime permanent.
Si la température évoluait au cours du temps, le mur serait
en régime transitoire.
Dans un système en état d’équilibre, on
appelle équation d’état toute relation entre les variables
d’état.
En Physique des milieux continus, la Thermodynamique est définie comme la science qui étudie les phénomènes où intervient la température. Elle est née vers les années 1820, au début de l’ère industrielle, de la nécessité de connaître, sur les machines thermiques construites, la relation entre les phénomènes thermiques et les phénomènes dynamiques, d’où son nom.
1.2. Transformations d’un système
Dans une transformation il y a variation d’au moins une variable
d’état du système qui évolue d’un
état initial
à un état final. Sauf pour les systèmes fermés,
isolés où il y a transformation spontanée du système
vers un état d’équilibre si celui-ci n’était pas en
état d’équilibre, la transformation se produit par l’action
du milieu extérieur.
Pour que la transformation puisse être définie convenablement,
il conviendra que les états initial et final soient des états
d’équilibre.
Si état initial et état final sont identiques,
la transformation est appelée cycle.
Les différents types de transformations
Transformations quasistatiques
Si dans une transformation, le système reste, à chaque
instant, très voisin d’un état d ’équilibre, la transformation
est dite quasistatique. A chaque instant, en première approximation,
les variables d’état restent définies.
Transformations réversibles
Une transformation est dite réversible si le système
évolue en passant par une suite continue d’états d’équilibre
et
s’il existe une transformation permettant de ramener le système
et le milieu extérieur, à chaque instant, à l’équilibre
précédent. De fait, cette transformation ramène système
et milieu extérieur dans leurs états initiaux.
Il y a contradiction entre état d’équilibre et évolution,
aussi une transformation réversible n’est pas réalisable
en toute rigueur. On peut, au mieux, s’en approcher par une transformation
quasistatique avec possibilité de revenir à l’état
précédent.
Transformations irréversibles
Ce sont toutes celles qui ne remplissent pas les conditions de la réversibilité.
Remarque
A chaque instant d’une transformation réversible, voire quasistatique,
on peut écrire les équations d’état du système.
On trouve, en plus, une relation entre les variables d’état liées
à la transformation. Il ne faut pas donner un statut d’équation
d’état à cette dernière relation.
2.1. Pression dans un fluide au repos (en équilibre dans un référentiel galiléen)
Notre sens commun nous fait appréhender un fluide (gaz ou liquide) comme étant de nature très différente d’un solide. Ce dernier a une forme propre qui nous permet de le reconnaître. Liquide ou gaz n’ont pas de forme propre, ils épousent la forme du récipient qui les contient, sont déformables sous la moindre action. Liquide et gaz ont des différences : un liquide, contrairement à un gaz, a un volume défini, il ne remplit pas tout le volume du récipient.
2.1.1. Etude expérimentale dans le champ de pesanteur
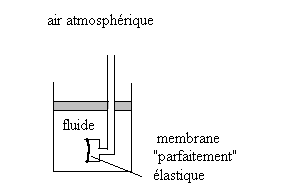 |
|
La forme de la membrane est indépendante de l’orientation de
la membrane autour d’un même point, les efforts sur la membrane sont
perpendiculaires à celle-ci.
Si le fluide est un liquide, la déformation de la membrane augmente
de manière significative avec la profondeur.
Autre expérience : si, dans un récipient contenant un liquide, nous perçons un trou, l’écoulement de liquide se produit perpendiculairement à l’orifice quelque soit l’orientation de ce dernier.
2.1.2. Définition de la pression dans un fluide
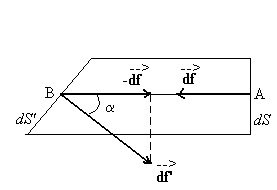 |
Considérons un fluide en équilibre
dans un référentiel lié au sol supposé galiléen
et une portion de ce fluide limitée extérieurement par un
cylindre élémentaire de révolution d’axe AB horizontal
et dont les bases sont, en A une section droite dS, en B la surface plane
dS’ dont la normale fait un angle a avec l’axe
AB.
Nous avons |
Cette portion de fluide n’est pas soumise qu’à son seul poids
(voire à d’autres forces dues à un champ extérieur)
pour être en équilibre. Elle est soumise à des forces
" superficielles " (sur les surfaces délimitant le cylindre) dues
au fluide extérieure environnant la portion, les forces internes
à la portion n’interviennent pas car elles obéissent au principe
de l’action et de la réaction.
Les forces ![]() exercées
par le fluide environnant sur les bases (non matérielles) dS et dS’ du
volume élémentaire de fluide sont normales à celles-ci
(sinon il y aurait glissement entre les couches du fluide puisqu’un fluide se
déforme à la moindre action extérieure).
exercées
par le fluide environnant sur les bases (non matérielles) dS et dS’ du
volume élémentaire de fluide sont normales à celles-ci
(sinon il y aurait glissement entre les couches du fluide puisqu’un fluide se
déforme à la moindre action extérieure).
La condition d’équilibre sur l’axe horizontal se traduit par ![]() .
.
Soit ![]() qui,
par définition, est la pression dans le fluide.
qui,
par définition, est la pression dans le fluide.
La pression p en un point d’un fluide en équilibre est indépendante
de l’orientation de l’élément de surface qui sert à
la définir.
La pression est une grandeur scalaire positive, la force de pression
est une grandeur vectorielle.
La pression est la même en tous les points d’un plan horizontal
pris dans un fluide en équilibre.
2.1.3. Relation locale traduisant l’équilibre d’un fluide dans un référentiel galiléen
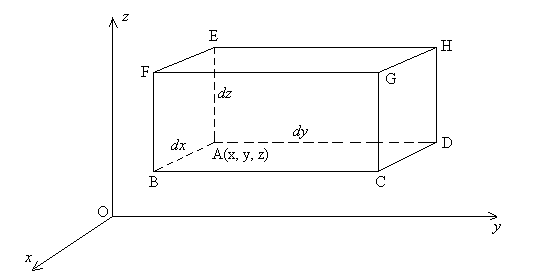
Exprimons la relation d’équilibre pour un élément
de fluide en forme de parallèpipède rectangle de dimensions
dx,
dy et dz à partir du point A de coordonnées
x,
y et z.
Sur la surface rectangulaire ABFE, nous avons une pression ![]() et, sur la surface rectangulaire DCGH, nous avons une pression
et, sur la surface rectangulaire DCGH, nous avons une pression ![]() .
.
Il en est de même sur les autres faces du parallèpipède
rectangle en permutant les coordonnées. Les forces dues à des
champs de forces extérieures s’écrivent ![]() .
.
En appliquant les relations d’équilibre de la Mécanique et en
projetant suivant la direction Oy, on obtient ![]() .
.
Soit encore ![]()
![]()
![]()
Sous forme vectorielle, ces trois dernières relations s’écrivent
:
![]()
Remarque : le gradient de pression n’est due qu’aux champs de forces extérieures.
2.2. Cas d’un fluide au repos dans le champ de pesanteur
Principe de l’hydrostatique (dit de Pascal)
Le fluide a pour masse volumique m
et le champ de pesanteur est le seul champ de forces extérieures.
Dans ce cas ![]() relation équivalente à
relation équivalente à ![]() si l’axe
si l’axe ![]() est
vertical ascendant. Ceci constitue le principe de l’hydrostatique ou
principe de Pascal.
est
vertical ascendant. Ceci constitue le principe de l’hydrostatique ou
principe de Pascal.
Autre démonstration :
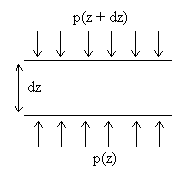 |
Dans le champ de pesanteur, on considère
une tranche de fluide à l'altitude z d'épaisseur L'axe des z est vertical ascendant, on appelle L'écriture du principe fondamentale de la dynamique conduit à |
L’augmentation de pression entre une altitude z + dz et une altitude
z
est due au poids du fluide dans le cylindre de hauteur verticale
dz
et de surface horizontale unitaire.
L’évolution de pression est donc continue, même à
la séparation de deux fluides.
La pression a une altitude z est égale au poids, par
unité de surface horizontale, des couches de fluide situées
à la verticale au-dessus de z.
Dans un même fluide au repos, les surfaces d’égale altitude
sont isobares (même pression).
Dans le système MKSA, les pressions se mesurent en N m-2
que l’on appelle Pascal (Pa).
Attention, il ne faudrait pas conclure que les forces de pression s’exercent verticalement. Elles s’exercent perpendiculairement à tout élément de surface.
2.2.1. Surface de séparation entre deux fluides non miscibles au repos
Considérons deux points de cette surface. Soit dz leur
différence d’altitude.
On peut écrire, en négligeant toute discontinuité
de la pression à la traversée de la surface de séparation
:
![]() ce qui entraîne
dz = 0.
ce qui entraîne
dz = 0.
La surface de séparation entre deux fluides non miscibles
au repos est plane et horizontale.
L’étude de la stabilité de l’équilibre montrerait que le liquide de densité plus faible se place au dessus de celui de densité plus forte.
2.2.2. Fluide incompressible (liquide)
La masse volumique est constante et l’intégration du principe de l’hydrostatique
donne ![]()
Applications : baromètre - presse hydraulique
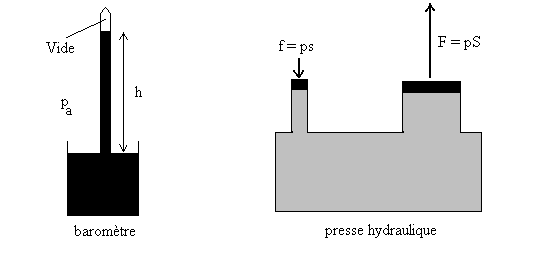
Dans un baromètre à mercure, pour une pression atmosphérique
normale, la hauteur h est égale à 760 mm ce qui correspond à ![]() .
.
Souvent, les pressions sont exprimées en mm de mercure, en atmosphère
( 1 atm correspond à la pression atmosphérique normale),
en bar (1 bar = 105 Pa) ou millibar (mbar).
Nous remarquerons que pour une hauteur d’eau de 3m, la variation de
pression est égale à 30000 Pa soit à peu près
le tiers de la pression atmosphérique normale.
A l’échelle humaine courante, les variations de pression
sont sensibles dans les liquides.
Un baromètre mesure une pression absolue puisque la pression dans le vide est nulle (pas de masse = pas de poids). Les manomètres qui mesurent les différences de pression seront étudiés en Travaux dirigés et pratiques.
2.2.3. Fluide compressible (gaz)
La masse volumique dépend de la pression et nous le verrons de
la température. On ne peut intégrer directement la relation
dp
= -mg dz.
Cependant les masses volumiques des gaz sont faibles (air dans les
conditions courantes 1,3 Kg m-3)
et, à l’échelle humaine courante, on négligera
les variations de pression avec l’altitude dans les gaz.
Seul l’air atmosphérique présente des différences
d’altitude suffisantes pour ne pas négliger les variations de pression.
2.2.4. Théorème d’Archimède et corps flottants
Théorème d’Archimède
Considérons (Fig. a) un corps entièrement immergé dans un fluide homogène au repos. Il occupe un volume V et subit de la part du fluide des forces de pression.
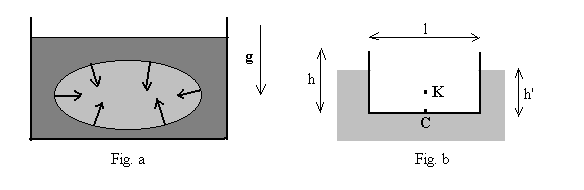
" Tout corps plongé dans un fluide en équilibre est soumis
de la part de celui-ci à une poussée verticale, dirigée
de bas en haut, égale au poids du liquide de remplacement et appliquée
à son centre de masse appelé centre de carène. "
En effet, en l’absence de corps immergé, le fluide de remplacement
serait en équilibre sous l’action des forces de pression exercées
par le fluide environnant et des forces de pesanteur. Les forces de pression
sont l’opposé du poids du fluide de remplacement.
Autre démonstration : nous appliquons le théorème
du gradient (cas particulier du théorème d’Ostrogradsky)
pour la résultante des forces de pression sur une surface fermée
S
contenant le volume V.
![]() (le vecteur
(le vecteur ![]() est orienté vers l’extérieur de la surface fermée)
est orienté vers l’extérieur de la surface fermée)
Ce théorème reste vrai si le corps est immergé
dans plusieurs fluides en équilibre.
Statique des corps flottants
Lorsque le poids du liquide de remplacement est supérieur au poids du corps, seule une partie de ce dernier est immergée. Le corps est alors soumis à deux forces : son poids, appliqué au centre de masse C, et la poussée d’Archimède appliquée au centre de carène K.
A titre d’exemple, considérons l’équilibre d’une
boîte parallélépipédique à section rectangulaire
ouverte flottant sur l’eau (Fig. b). Une telle boîte, de dimensions
L
= 10 m, l = 4 m, h = 3 m et de masse M = 20
t,
constitue un modèle simplifié d’une embarcation flottant
sur l’eau. Elle s’enfonce dans l’eau d’une hauteur h’ telle que
:
![]()
Notons que, la boîte étant ouverte et les parois latérales
de masse négligeable, le centre de masse C est situé au centre
de la base rectangulaire, alors que le centre de carène K est au-
dessus de lui à la distance h’/2 . Dans ce cas, l’équilibre
est stable : une légère rotation de la boîte autour
de l’axe longitudinal passant par le centre de masse produit des oscillations
autour de la position d’équilibre.
L’étude de la stabilité de la position d’équilibre, évidemment capitale dans la construction des navires, n’est pas au programme.
2.3. Relation locale traduisant l’équilibre d’un fluide dans un référentiel non galiléen
En Mécanique, on apprend que le mouvement d’une masse " ponctuelle "
m (mieux : le mouvement du centre de masse d’un système
matériel de masse totale m) est régi, dans un référentiel
non galiléen, par la relation ![]() où on introduit les forces d’entraînement et de Coriolis.
où on introduit les forces d’entraînement et de Coriolis.
L’absence de mouvement relatif imposent accélération et vitesse
relatives nulles et donc ![]() et
et ![]()
Par suite, la relation d’équilibre s’écrit ![]()
Pour le champ de forces extérieures de pesanteur ![]()
2.4. Phénomènes de tension superficielle
Une molécule au sein d’un liquide est soumise de la part des autres
molécules à des forces de Van der Waals d’origine électromagnétique
qui varient en ![]() .
Ce type d’interaction décroît très rapidement et peut être
négligé au-delà d’une distance de l’ordre d’une dizaine
de nanomètres.
.
Ce type d’interaction décroît très rapidement et peut être
négligé au-delà d’une distance de l’ordre d’une dizaine
de nanomètres.
A la surface de séparation de deux fluides (liquide-gaz ou liquide-liquide),
la situation est différente en particulier l’isotropie des forces
qui existe au sein d’un fluide n’est plus la règle et il apparaît
un système de forces différent dans la couche capillaire
(couche de liquide proche de la surface de séparation de deux fluides
et dont l’épaisseur est de l’ordre du nanomètre).
A titre d’exemples, chacun visualisera que l’on peut soulever une pellicule
d’eau savonneuse avec un anneau et qu’en soufflant sur cette pellicule
on peut former un bulle de savon dont la surface en forme de sphère
est tendue.
2.4.1. Tension superficielle
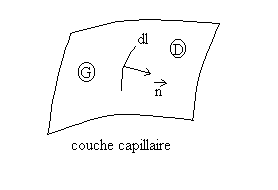 |
Les phénomènes observés
suggère de traiter la couche capillaire comme une membrane élastique
supposée d’épaisseur nulle.
Effectuons une incision de longueur dl dans la couche capillaire. Les lèvres s’écartent ce qui signifie que préalablement à l’incision, la partie droite D de la couche capillaire exerçait sur l’élément dl appartenant à la partie de gauche G une force attractive |
|||
|
|
|
|
Remarque : La partie droite D de la couche capillaire peut être remplacée par un solide,la force garde la même valeur | |
| eau |
|
|
||
| éthanol |
|
|
||
| glycérine |
|
|
||
| eau |
|
|
||
| Plongeons un tube de faible diamètre (capillaire)
dans un liquide contenu dans une cuve de grandes dimensions.Le liquide s’élève
dans le tube. Ce phénomène s’appelle capillarité
et la loi de Jurin permet d’en rendre compte.A partir de loi de Laplace,
on montre la loi de Jurin : |
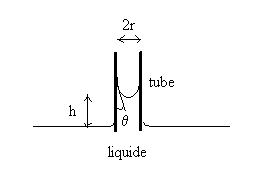 |
L’angle q de contact dépend de l’interface : il est de 0° pour les interfaces eau-verre propre et éthanol-verre propre et respectivement de 140°, 90° et 107° pour les interfaces mercure-verre, eau-argent et eau-paraffine.
2.4.4. Mesure des tensions superficielles
Il existe plusieurs méthodes de mesure des tensions superficielles. Nous citerons celle utilisant directement la loi de Jurin, celle utilisant l’arrachement d’un solide du liquide et celle utilisant le détachement des gouttes de liquide d’un tube.
3. Température et équation d’état des gaz parfaits
" Il fait chaud ", " il fait froid ", " c’est chaud ", " c’est froid
" ... que d’expressions du langage courant pour traduire le fait que la
température fait partie du quotidien humain.La première notion
de température est physiologique, sensitive.
Cependant, nos sensations sont insuffisantes pour établir une
échelle de température et comparer des températures.
L’observation, l’expérience nous apprennent qu’un même
système change (par exemple changement de volume) lorsque nos sensations
de température évoluent. Ce constat va nous permettre de
préciser quantitativement le paramètre physique température.
3.1. Principe de Thermométrie (ou Principe 0 de la Thermodynamique)
Considérons deux corps isolés en état d’équilibre.
Mis en contact thermique entre eux (à ce stade de nos connaissances
en contact physique) ils évoluent vers de nouveaux états
d’équilibre.
Le principe 0 de la Thermodynamique affirme que la variable d’état
température est caractéristique des états d’équilibre
atteints.
En d’autres termes et en raisonnant de proche en proche, des systèmes
mis en contact thermique évoluent vers des états d’équilibre
où ils ont même température.
3.2. Echelles de température. Echelle légale
3.2.1. Thermométrie et grandeur thermométrique
La température n’est associée à aucune loi physique,
nous pouvons donc choisir des valeurs arbitraires correspondant à
des états d’équilibre déterminés. Ainsi la
température peut être la valeur d’une grandeur physique (ou
une fonction monotone arbitraire de cette grandeur) d’un système
à condition d’établir une correspondance bi-univoque entre
grandeur physique et température. Par comparaison des états
d’équilibre d’autres systèmes avec ceux du système
choisi, on mesurera la température des autres systèmes.
Le système choisi est appelé thermomètre,
la grandeur physique grandeur thermométrique.
Exemple : le thermomètre est un fil, la grandeur thermométrique
sa longueur.
La longueur dépend de la température puisque, si je "
chauffe " le fil (je change ma sensation de toucher, je conclus que la
température a varié) je constate que la longueur varie.
La température peut être définie soit comme la
valeur de la longueur elle-même, soit comme une fonction monotone
arbitraire de cette longueur.
Il suit que pour rendre la notion de température quantitativement
utilisable par chacun, il a fallu définir une échelle
universelle c’est à dire un thermomètre de référence,
une grandeur thermométrique et une fonction monotone entre cette
grandeur et la température.
La Science ne s’est pas faite en un jour et la définition actuelle
de l’échelle légale de température est le résultat
de tâtonnements successifs. C’est pourquoi, de nos jours, au quotidien,
coexistent l’échelle Kelvin, l’échelle Celsius, l’échelle
Farenheit, seule l’échelle Réaumur est tombée en désuétude.
3.2.2. Faits expérimentaux
Points fixes
Certains états d’équilibre sont particulièrement
utiles car facilement reproductibles. On les appelle points fixes.
Il s’agit des états d’équilibre de deux phases d’un même
corps pur sous une pression donnée (solide en fusion, liquide en
ébullition, ...) ou de trois phases d’un même corps pur ce
qui se produit à une certaine pression (point triple).
Ces états d’équilibre sont facilement reproductibles
car indépendants des masses des phases en présence.
Exemple : la résistance ou la longueur d’un fil de platine immergé dans un mélange de glace et d’eau sous une pression donnée est indépendante des masses d’eau et de glace en présence et reprend toujours la même valeur si on refait le mélange, la pression étant inchangée.
Nous savons reproduire facilement des températures.
Le gaz parfait, limite de comportement de tous les gaz réels.
L’expérience montre que, si l’on trace les courbes de compressibilité isotherme pour un nombre donné de molécules, on obtient dans un diagramme p, pV (dit diagramme d’Amagat) les courbes ci-après.
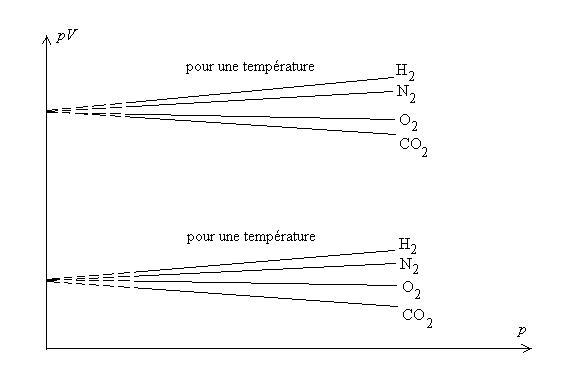
![]() a la même
valeur pour une température q fixée.
Cette limite est proportionnelle au nombre de molécules N ou de
moles n ( N = nN
où N = 6,023 1023
est le nombre d’Avogadro). Cette limite est indépendante du gaz considéré.
a la même
valeur pour une température q fixée.
Cette limite est proportionnelle au nombre de molécules N ou de
moles n ( N = nN
où N = 6,023 1023
est le nombre d’Avogadro). Cette limite est indépendante du gaz considéré.
Ainsi ![]() pour
tous les gaz.
pour
tous les gaz.
Définition du gaz parfait : Un gaz qui aurait,
quelle que soit la pression, le comportement de tout gaz réel à
pression nulle est appelée gaz parfait.
Les variables d’état pression p, volume V, température
q et nombre de moles n sont liées
par l’équation d’état ![]()
3.2.3. Echelle légale de température
Le Kelvin : proposé en 1954, adopté en 1967 par le Comité International des Poids et Mesures, le Kelvin est défini de la manière suivante :
Remarque : pV = nRT équation liant les variables
d'état du gaz parfait est appelée équation d’état
des gaz parfaits. Historiquement, cette relation est connue sous le
nom de loi de Boyle-Mariotte.
Bien que valable en toute rigueur à la pression nulle, cette
équation s’applique avec des précisions très satisfaisantes
jusqu’à des pressions de quelques atmosphères pour les gaz
réels.
Dans les exercices-type ou mieux dans "l'annexe 1 : Détermination
expérimentale des caractéristiques thermodynamiques" le lecteur
trouvera des équations d'état pour les gaz réels.
3.2.4. Autres échelles de température
Pour les échelles Celsius (notation t), Farenheit (notation
F)
et Réaumur (notation R), seule diffère dans la définition
la fonction monotone qui reste linéaire mais de la forme pV =
aq + b.
Les correspondances sont souvent établies de la manière
suivante :
![]()
où ![]() correspondent respectivement aux points fixes d’ébullition de l’eau et
de fusion de la glace sous la pression atmosphérique normale, les températures
respectives étant 373,15 K et 273,15 K soient encore 100
°C et 0 °C.
correspondent respectivement aux points fixes d’ébullition de l’eau et
de fusion de la glace sous la pression atmosphérique normale, les températures
respectives étant 373,15 K et 273,15 K soient encore 100
°C et 0 °C.
Il y a une simple translation entre les échelles Celsius et
Kelvin (t = T - 273,15).
3.3. La mesure des températures
Mis à part quelques laboratoires spécialement équipés,
on ne mesure pas une température avec un " thermomètre à
gaz parfait ".
On se sert de thermomètres (et grandeurs thermométriques)
que l’on étalonne, dans la gamme de température d’utilisation,
à partir des valeurs des températures de points fixes déterminées
par ces quelques laboratoires.
3.3.1. Points fixes fondamentaux
On trouvera ci-après les températures officielles assignées
à certains points fixes ; ces valeurs, sauf pour les points triples,
correspondent à des états d’équilibre sous la pression
atmosphérique normale.
|
|
|
|
| Point d'ébullition de l'hélium |
|
|
| Point triple de l'hydrogène |
|
|
| Point d'ébullition de l'hydrogène à 33330,6 Pa |
|
|
| Point d'ébullition de l'hydrogène |
|
|
| Point d'ébullition du néon |
|
|
| Point triple de l'oxygène |
|
|
| Point d'ébullition de l'oxygène |
|
|
| Point de fusion de l'eau |
|
|
| Point triple de l'eau |
|
|
| Point d'ébullition de l'eau |
|
|
| Point de fusion du Zinc |
|
|
| Point de fusion de l'argent |
|
|
| Point de fusion de l'or |
|
|
3.3.2. Les thermomètres
Les thermomètres à liquide comprennent un réservoir
dont le volume n’excède pas 1 cm3
soudé à une tige capillaire de diamètre intérieur
de quelques dixièmes de millimètre. La paroi est mince pour
permettre l’établissement rapide de l’équilibre thermique.
Avec une bonne approximation, on peut considérer que le volume V
du liquide dans le thermomètre varie avec la température suivant
la relation ![]()
Pour le mercure dans le verre, on prend pour a la valeur moyenne 1/6300.
Au-dessous de -39 °C, on utilise l’éthanol jusqu’à
-80 °C, le toluène jusqu’à -90 °C,
le pentane jusqu’à -200 °C.
Au-dessus de 500 °C, le gallium permet d’atteindre 1000
°C.
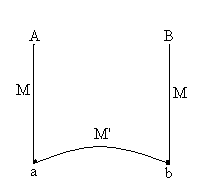 |
Trois fils constitués de deux métaux
ou alliages différents M et M’ sont soudés (ou en contact)
en a et b où règnent des températures Des relations de type Leur domaine d’utilisation varie entre -180 et 2500 °C. |
3.3.3. Thermométrie
Mesurer une température s’avère souvent difficile ; en
effet, faire un étalonnage précis d’un thermomètre
soulève des problèmes, introduire le thermomètre à
l’endroit où l’on veut connaître la température perturbe,
parfois notablement, la température.
Nous n’en dirons pas plus dans le cadre de ce cours.
4. Applications simples de l’équation d’état des gaz parfaits
4.1. Un gaz parfait obéit aux lois de Gay-Lussac et de Charles
On dit qu’un gaz obéit à la loi de Gay-Lussac si, à
pression constante, son volume est proportionnel à la température.
On dit qu’un gaz obéit à la loi de Charles si, à
volume constant, sa pression est proportionnelle à la température.
Pour un gaz parfait à ![]() (Loi de Gay-Lussac)
(Loi de Gay-Lussac)
Pour un gaz parfait à ![]() (Loi de Charles)
(Loi de Charles)
4.2. Un gaz qui obéit aux lois de Gay-Lussac et de Charles est un gaz parfait
Loi de Gay-Lussac : à ![]() .
Si on change la valeur de p, cette dernière constante change.
C’est donc une fonction de
.
Si on change la valeur de p, cette dernière constante change.
C’est donc une fonction de![]()
Loi de Charles : à ![]() .
Si on change la valeur de V, cette dernière constante change.
C’est donc une fonction de
.
Si on change la valeur de V, cette dernière constante change.
C’est donc une fonction de ![]()
En réunissant ces deux résultats, on obtient ![]() .
.
Soit ![]() puisque
la relation doit être vraie quels que soient V et p.
puisque
la relation doit être vraie quels que soient V et p.
![]() soit encore
pV = CT
soit encore
pV = CT
4.3. Mélange idéal de gaz parfaits
Dans une enceinte de volume V, nous mélangeons différentes
substances chimiques en phases gazeuses sans possibilité de réactions
chimiques entre elles. Le mélange est dit idéal.
Si p la pression du mélange est suffisamment faible,
l’expérience montre que :
![]() est le nombre
de moles du gaz i et n le nombre total de moles gazeuses sans distinction
de la substance gazeuse.
est le nombre
de moles du gaz i et n le nombre total de moles gazeuses sans distinction
de la substance gazeuse.
Le mélange se comporte comme un gaz parfait.
Si le gaz i était seul dans l’enceinte, il se comporterait comme un
gaz parfait et sa pression ![]() serait donnée par la relation
serait donnée par la relation ![]() .
.
On remarquera que la pression p dans le mélange est liée
aux pressions ![]() par la relation
par la relation ![]() .
.
![]() est appelée
pression partielle du gaz i dans le mélange. La pression du mélange
est la somme des pressions partielles.
est appelée
pression partielle du gaz i dans le mélange. La pression du mélange
est la somme des pressions partielles.
On appelle fraction molaire du gaz i dans le mélange, la quantité ![]() .
.
On déduit que ![]() .
.
La quantité ![]() représente la masse totale du mélange si
représente la masse totale du mélange si ![]() est la masse molaire du gaz i.
est la masse molaire du gaz i.
On définit la " masse molaire du mélange " par 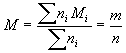 .
.
4.4. Autre écriture de l’équation d’état des gaz parfaits
pV = nRT s’écrit aussi pV = (m/M) RT = mrT où r = R/M.
Si N est le nombre de molécules du gaz, N = nN
où ![]() est le nombre d’Avogadro.
est le nombre d’Avogadro.
PV = nRT![]() pV = NkT où
pV = NkT où ![]() est la constante de Boltzmann.
est la constante de Boltzmann.
L’équation d’état des gaz parfaits s’écrit encore ![]() en introduisant
en introduisant ![]() la densité volumique molaire et
la densité volumique molaire et ![]() la densité volumique des molécules.
la densité volumique des molécules.
Remarque : localement la pression est proportionnelle à la densité
des molécules
4.5. Masse volumique et densité des gaz parfaits
Soit m = m/V la masse volumique. On obtient ![]() (autre
écriture de l’équation d’état des gaz parfaits).
(autre
écriture de l’équation d’état des gaz parfaits).
On appelle densité d’un gaz le rapport de la masse d’un certain
volume de gaz sur la masse du même volume d’air pris dans les mêmes
conditions de pression et de température.
![]() (en grammes)
(en grammes)