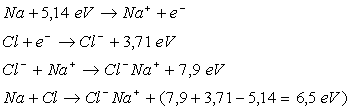Les particules de base de la matière
Plan
1. L’hypothèse atomique (ou moléculaire)
2. La particule de base
2.1. L'atome
2.2. Les particules de base
1. L’hypothèse atomique
(ou moléculaire)
L’hypothèse est banale (universellement admise). Elle était déjà émise par les philosophes de la Grèce antique. Par contre les premières preuves expérimentales - Dalton, Proust, Lavoisier au 19ème siècle - sont relativement récentes.
Si, dans un cataclysme, toute notre connaissance scientifique
devait être détruite et qu’une seule phrase passe aux générations
futures, quelle affirmation contiendrait le maximum d’information dans le minimum
de mots ? N’est ce pas l’hypothèse atomique à savoir " toutes
les choses sont faites d’atomes (de molécules), petites particules en
agitation incessante, s’attirant mutuellement à petite distance les unes
des autres et se repoussant si on cherche à trop les rapprocher ".
Dans cette seule phrase vous verrez qu’il y a une énorme quantité
d’informations sur le monde, si on lui applique un petit peu d’imagination et
de réflexion. The Feynman Lectures on Physics par Richard P. Feynman,
Robert B. Leighton et Mattews Sands.
Sans doute, cette phrase de Richard P. Feynman, prix Nobel
de Physique en 1965, est suffisante pour aborder un premier cours de Thermodynamique
à condition de la compléter par :
- un modèle pour l’atome à savoir il est identifiable à une " masse ponctuelle " assimilable à une " sphère rigide, très petite "
- un modèle pour la molécule qui est constituée d’atomes en très forte interaction entre eux c’est à dire à distances pratiquement constantes les uns des autres, soit encore vibrant avec des amplitudes très faibles autour de leur positions d’équilibre respectives.
Cette phrase est très insuffisante pour comprendre le comportement de la matière soumise à un champ électrique et/ou magnétique, pour aborder l’interaction onde-matière c’est à dire une physique dite " moderne " celle qui ne s’est construite qu’à partir du début du 20ème siècle.
La compressibilité des gaz, la presque incompressibilité des liquides et des solides permet de dire que les atomes d’un liquide ou d’un solide sont " entassés " les uns sur les autres alors que ceux d’un gaz sont éloignés les uns des autres. Ceci est confirmé par la masse volumique qui est faible (peu d’atomes par unité de volume) pour les gaz et importante pour les liquides et les solides, par le fait que nous nous sentons " léger " (forte poussée d’Archimède) dans l’eau et " lourd " dans l’air, que nous avons du mal à marcher dans l’eau, …
L’état gazeux est un état dilué alors que liquides et solides font partie des états condensés.
2. La particule de base
2.1. L'atome
Toute matière est constituée d'atomes.
L'atome est constitué d'un noyau comportant Z protons et d'un nombre
au moins égal de neutrons (à l'exception de l'atome d'hydrogène
qui ne comporte pas de neutron), de Z électrons gravitant autour du noyau.
En Chimie, on apprend qu’il existe une bonne centaine d’atomes " libres ".
Le tableau de Mendeleïev les regroupe de manière ordonnée
suivant leurs caractéristiques. Les théories quantiques actuellement
admises ont considérablement perfectionné ce modèle atomique
élémentaire rappelé ici.
La masse du proton est égale à 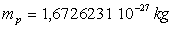 et sa charge
et sa charge  .
.
La masse du neutron est égale à 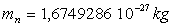 ,
il est électriquement neutre.
,
il est électriquement neutre.
La masse de l'électron est égale à 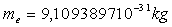 et sa charge est égale et opposée à celle du proton.
et sa charge est égale et opposée à celle du proton.
Chacun des Z électrons est dans un " état
" caractérisé, entre autres, par l'énergie qu'il faut
dépenser pour le libérer sans vitesse appréciable de l'atome.
Les valeurs de ces énergies permettent de classer les Z électrons
en " couches " de même énergie où le
nombre possible d'électrons est limité. Les niveaux d’énergie
entre couches sont nettement séparées au moins pour les plus fortes
valeurs.
On distingue ces couches en introduisant un nombre entier positif n appelé
nombre quantique principal. Ainsi, la couche la plus profonde (première
à partir du noyau) appelée K correspond à 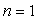 ,
la seconde L à
,
la seconde L à 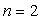 et ainsi de suite.
et ainsi de suite.
Pour l’atome d’hydrogène (et pour les ions hydrogénoïdes
qui, comme l’atome d’hydrogène ne possèdent qu’un électron),
l’énergie de l’électron suivant la couche où il se trouve
est égale à : 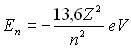 .
.
Pour des atomes ou des ions polyélectroniques, les règles de Slater
pour calculer l’énergie d’un électron d’une couche constituent
une bonne approximation empirique.
Pour 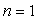 , la formule
ci-dessus reste valide ; pour l'Uranium (
, la formule
ci-dessus reste valide ; pour l'Uranium (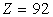 ),
les mesures donnent 115600 eV.
),
les mesures donnent 115600 eV.
Les électrons d’une couche " tournent " sur des orbites définies par les nombres quantiques secondaire et magnétique.
Le nombre d’orbitales atomiques (ou orbites possibles pour
l’électron) pour une couche de nombre quantique principal n est égal
à 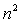 nombre
de combinaisons différentes entre les valeurs des nombres quantiques
secondaire et magnétique.
nombre
de combinaisons différentes entre les valeurs des nombres quantiques
secondaire et magnétique.
L’interprétation de l’expérience de Stern et Gerlach montre qu’il
convient d’introduire un moment cinétique propre au mouvement de l’électron
sur lui-même. A ce moment cinétique, est associé un
moment cinétique de spin dont la projection suivant la direction
du champ magnétique imposé est égal à 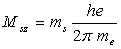 où
où 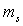 est
le nombre quantique magnétique de spin. Ce nombre ne peut prendre
que les deux valeurs
est
le nombre quantique magnétique de spin. Ce nombre ne peut prendre
que les deux valeurs 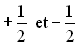 .
.
Suivant le principe de Pauli, deux électrons d’un atome ne peuvent
avoir leurs quatre nombres quantiques identiques.
2.2. Les particules de base
Etablir un modèle de structure de la matière
consiste à décrire l'arrangement des atomes, en représentant
leurs positions respectives et la répartition des différentes
espèces. Ce qu'on pourrait imaginer de plus simple serait que les atomes
se comportent comme des constituants, doués de propriétés
spécifiques, parfaitement définis et immuables. Ce n’est pas aussi
simple puisque les atomes apparaissent dans la matière avec des petites
différences par rapport au schéma de l'atome libre qui fait l'objet
du tableau de Mendeleïev. Ces petites différences sont essentielles
pour rendre compte des propriétés de la matière.
En fait, dans une transformation physique ou une réaction chimique, seul
l'état des quelques électrons externes peut être modifié.
La ménagère sur sa cuisinière, le chimiste dans son laboratoire,
le métallurgiste avec son haut-fourneau ou son four à arc ne peut
qu'égratigner les atomes. Avec une excellente approximation, le noyau
et tous les électrons sauf les quelques uns des couches externes sont
immuables.
Toute matière est faite d'un ensemble " d'entités ",
comme une construction est faite de briques, différentes suivant la matière.
Nous désignons ces entités par le terme " particule "
ou mieux " particule de base ". Dans quelques cas rares ce
sont des atomes tels qu'ils sont à l'état libre, plus souvent
des atomes modifiés par l'altération des couches électroniques
externes ou des groupes d'atomes définis appelés " molécules
".
La " particule de base " est représentée par un objet
de forme et de dimensions déterminées et le modèle de la
matière est l'assemblage de ces objets. Ainsi un atome est représenté
par une sphère de diamètre donné et un ensemble d'atomes
par de telles sphères pressées les unes contre les autres. A priori
cette représentation n'est pas évidente mais elle apporte une
image simplificatrice primordiale pour notre compréhension de la structure
de la matière.
La molécule mono et polyatomique
Les gaz rares sont caractérisés par une couche
électronique externe complète (qui ne peut accepter un électron
de plus). Cette propriété les fait bénéficier d'une
stabilité toute particulière qui les rend pratiquement inerte
et la particule de base est faite d'un atome non altéré. On parle
de molécules monoatomiques.
Les atomes, autres que les gaz rares, se lient entre eux suivant des schémas
bien définis formant un ensemble stable appelé molécule
polyatomique. La liaison interatomique provoque l'altération de l'état
des électrons des couches externes. Décrire les modes de liaisons
et les mécanismes des " réactions " relève du
domaine de la Chimie, le minimum à connaître étant
les règles de " remplissage ".
Dans la matière à l'état dilué (gaz), la
molécule (à l’exception des plasma qui sont constitués
d’ions et d’électrons) est la particule de base.
Dans celle à l'état condensé (liquide et solide),
- pour ce qui concerne les liquides (à l’exception des liquides ioniques et des cristaux liquides), la particule de base est la molécule
- pour ce qui concerne les solides (à l’exception des solides amorphes et des solides moléculaires) la particule de base est soit l’atome, soit l’ion.
Les atomes, éléments de la matière condensée
Ce sont bien des atomes mais ils n'ont pas exactement la même
constitution que l'atome de même espèce à l'état
isolé. En effet, quand la matière est condensée, cela signifie
que chaque atome se trouve au contact d'autres, donc qu'il est soumis à
des interactions qui altèrent l'état des électrons de la
couche superficielle.
C'est ce qui se passe pour les atomes formant les molécules, la différence
essentielle est que, dans la molécule, les atomes constituants forment
un système fini, bien défini, auquel on ne peut adjoindre ou retirer
un atome sans modifier profondément la molécule. Au contraire,
dans un solide dont les éléments constitutifs sont des atomes,
ceux-ci forment des chaînes en interaction non finies.
Nous illustrons notre propos avec l'atome de Carbone qui possède 6 électrons,
2 sur sa première couche (K) qui est complète et quatre sur sa
deuxième couche (L) externe qui peut être complétée
à 8.
Avec 4 atomes d'Hydrogène, le Carbone forme la molécule 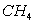 ,
ensemble fini, où le Carbone partage les 4 électrons des atomes
d'Hydrogène pour compléter sa couche externe, où chaque
atome d'Hydrogène partage 1 électron de l'atome de Carbone pour
compléter sa seule couche à 2 électrons.
,
ensemble fini, où le Carbone partage les 4 électrons des atomes
d'Hydrogène pour compléter sa couche externe, où chaque
atome d'Hydrogène partage 1 électron de l'atome de Carbone pour
compléter sa seule couche à 2 électrons.
Dans le solide diamant, un atome de Carbone partage 1 électron avec chacun
des 4 atomes de Carbone qui l'entourent pour compléter sa couche externe,
ces derniers en faisant de même si bien que les atomes du diamant forment
des chaînes bien déterminées qui se développent dans
toutes les directions. Il n'y a pas de molécule de diamant. En ce qui
concerne les atomes de Carbone à la surface du diamant, ils complètent
leur couche externe avec des impuretés de l'atmosphère environnante
pour assurer la stabilité de l'édifice diamant.
Les ions, éléments de la matière condensée
Un atome, dont le nombre atomique est supérieur de quelques
unités (1, 2, 3, voire 4) à celui d'un gaz rare, retrouve la configuration
électronique de celui-ci s'il perd ses électrons extérieurs.
Cette opération, qui nécessite peu d'énergie, explique
l’existence des solides et liquides métalliques . L'atome n'est plus
électriquement neutre : il devient un ion chargé positivement
-cation- de 1, 2, ... charges élémentaires, environné
d’un nombre égal d’électrons " libres ". L’existence
de charges positives et négatives, qui s’attirent, donnent une cohésion
à l’assemblage.
Inversement, si l'atome à 1, 2, ... électrons de moins qu'un gaz
rare, des électrons libres (à énergie nulle) peuvent venir
occuper des places vacantes de la couche externe de niveau d'énergie
inférieure. L'atome devient un ion chargé négativement
-anion-.
La formation d’ions de nature opposée est spontanée si le bilan
énergétique est exothermique.
Exemple : 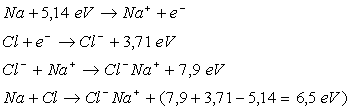
Il convient de bien comprendre.
A l’état gazeux il existe une molécule (dans l’exemple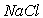 ).
Pour ce qui est de l’état solide ou liquide, il s’agit d’un ensemble
d'ions positifs et négatifs (dans l’exemple
).
Pour ce qui est de l’état solide ou liquide, il s’agit d’un ensemble
d'ions positifs et négatifs (dans l’exemple 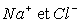 )
qui, en s’attirant, assurent la cohésion de l’édifice. Dans cet
ensemble, il n'y a pas de couples isolés (
)
qui, en s’attirant, assurent la cohésion de l’édifice. Dans cet
ensemble, il n'y a pas de couples isolés (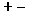 ),
donc pas de molécule : la particule de base du modèle est bien
l'ion, c'est à dire un atome modifié dans sa couche extérieure
par la perte ou le gain d'un petit nombre d'électrons.
),
donc pas de molécule : la particule de base du modèle est bien
l'ion, c'est à dire un atome modifié dans sa couche extérieure
par la perte ou le gain d'un petit nombre d'électrons.
Nos exemples définissent l'ion à partir d'un atome. Il existe
des ions plus complexes constitués de plusieurs atomes liés entre
eux comme dans une molécule, la charge des électrons et des noyaux
ne se compensant pas totalement.
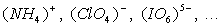
La dimension des ions, atomes et molécules
La masse des particules ne pose pas de problème particulier.
Dans l'atome, toute la masse est pratiquement concentrée dans le noyau
à environ 1/4000 près ou moins. La modification de l'état
des électrons, et de légers changements dans leur nombre, ne font
pas varier la masse qui est simplement celle du ou des noyaux constituant la
particule.
Les dimensions géométriques sont plus délicates à
définir. Dans l'image qu'en donne la mécanique quantique, l'atome
libre est constitué par un nuage d'électricité négative,
de charge totale 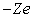 ,
autour du noyau ponctuel de charge
,
autour du noyau ponctuel de charge 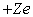 .
La densité locale de charge est calculable par les équations de
la mécanique quantique.
.
La densité locale de charge est calculable par les équations de
la mécanique quantique.
|
|
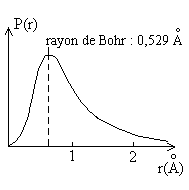
Pour l'atome d'Hydrogène qui peut être calculé rigoureusement, la figure ci-contre donne la probabilité de présence de l'électron à une distance r.
Elle est maximale pour la valeur du rayon de Bohr, égale à 50% pour r = 0,707 Å, à 90% pour r = 1,408 Å.
|
La situation est très différente dans les ensembles denses d'atomes qu'on observe dans la matière condensée, solide ou liquide.
- Le cas le plus simple est celui des ions où il est possible, expérimentalement,
de mesurer la distance entre deux ions
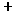 et
et
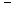 immédiatement
voisins. L'ensemble des mesures sur un grand nombre de cristaux ioniques conduit
à la règle fondamentale suivante : chaque espèce d'ions
peut, avec une bonne approximation, être assimilé à une
" sphère dure ", c'est à dire indéformable,
de rayon déterminé; la distance entre les centres de deux ions
voisins est égale à la somme des rayons attribués à
chacun des ions, tout comme s'il s'agissait de deux sphères indéformables
tangentes.
immédiatement
voisins. L'ensemble des mesures sur un grand nombre de cristaux ioniques conduit
à la règle fondamentale suivante : chaque espèce d'ions
peut, avec une bonne approximation, être assimilé à une
" sphère dure ", c'est à dire indéformable,
de rayon déterminé; la distance entre les centres de deux ions
voisins est égale à la somme des rayons attribués à
chacun des ions, tout comme s'il s'agissait de deux sphères indéformables
tangentes.
On montre que le rayon des ions homologues croit relativement peu avec Z, beaucoup moins que la masse atomique ce qui est logique si on considère qu’une charge de noyau croissante tend à rapprocher les électrons du centre mais que ceux-ci plus nombreux tendent à occuper un espace plus grand.
Dans les métaux, la particule de base est un ion positif, l'atome ayant perdu 1, 2 ou 3 électrons devenus libres et qui forment une " mer d'électricité " négative. La règle énoncée pour le calcul des rayons restent vraie mais on trouve des rayons d'atomes métalliques plus grands, quelque fois beaucoup plus grands, que les rayons d'atomes ioniques de même espèce. On explique cela en remarquant que les ions d'un métal se repoussent et que c'est la " mer " d'électrons qui les maintient à la distance où ils se trouvent. Le fait qui peut paraître étrange, c'est que, bien qu'un métal soit en réalité assez vide, ses ions se comportent comme des sphères dures au contact.
- Le cas des ensembles où la particule de base est la molécule (liquide) ou l'atome (solide cristallin) est beaucoup plus complexe.
Pour l'ion, la couche externe est devenue très stable et reste semblable quel que soit l'ion au contact. Ce n'est plus le cas et la liaison affecte la couche externe.
Ce qui est déterminé de façon précise
à partir des mesures sur les cristaux, c'est la distance entre les
centres d'un couple d'atomes voisins d'espèces données et liés
par une liaison de type donné. Ainsi par exemple, la distance 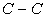 est de 1,54 Å, celle
est de 1,54 Å, celle 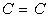 est de 1,34 Å, celle
est de 1,34 Å, celle 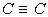 est de 1,20 Å. Par contre, si l'atome a comme voisin un atome d'une
autre molécule auquel il n'est donc pas lié, il pourra s'en
approcher jusqu'à une distance appelée rayon de Van der Waals
(pour le Carbone 1,80 Å). A l'intérieur d'une molécule
les sphères de Van der Waals des différents atomes s'interpénètrent
puisque les atomes d'une même molécule sont liés.
est de 1,20 Å. Par contre, si l'atome a comme voisin un atome d'une
autre molécule auquel il n'est donc pas lié, il pourra s'en
approcher jusqu'à une distance appelée rayon de Van der Waals
(pour le Carbone 1,80 Å). A l'intérieur d'une molécule
les sphères de Van der Waals des différents atomes s'interpénètrent
puisque les atomes d'une même molécule sont liés.
On accède, dans la matière condensée, au type d'empilement des molécules par la forme extérieure de la matière.
Remarque
Ce que nous venons d'expliquer est très simplifié.
En particulier, rien ne nous permet de comprendre ce qui empêche deux
atomes en interaction de se pénétrer jusqu'aux noyaux puisqu'ils
sont essentiellement constitués de vide. Il faut, pour cela, abandonner
les concepts classiques pour la mécanique quantique et introduire les
interactions nucléaires.