On prendra : pression de vapeur saturante de l’éther à 18 °C
Exercices sur les changements de phases
Méthodologie commune aux exercices ci-après
1 - On introduit une certaine masse d’éther liquide
dans une ampoule scellée de volume 20 cm3
préalablement vidée. La température pendant l’opération
reste constante et égale à 18 °C. Quelle sera la composition
en masse et volume de l’état d’équilibre final dans les deux cas
suivants :
1) on introduit 10 g d’éther
2) on introduit 0,02 g d’éther
On assimilera la vapeur à un gaz parfait.
On prendra : pression de vapeur saturante de l’éther à 18 °C
![]() ; masse
volumique de l’éther liquide
; masse
volumique de l’éther liquide ![]() ;
masse molaire de l’éther 74 g.
;
masse molaire de l’éther 74 g.
| Réponse 1) | Réponse 2) |
2 - Un cylindre muni d’un piston contient une mole d’eau
M = 18 g à l’état de vapeur. Les parois du cylindre
sont supposées perméables à la chaleur et placées
dans un bain dont on peut régler la température T. On considèrera
la vapeur, même à l’état de vapeur saturante, comme un gaz
parfait.
1) La température étant maintenue à ![]() ,
on comprime la vapeur de manière réversible du volume
,
on comprime la vapeur de manière réversible du volume ![]() au volume
au volume ![]() . La
vapeur se trouve alors partiellement liquéfiée, la pression étant
. La
vapeur se trouve alors partiellement liquéfiée, la pression étant
![]() .
.
1)1) Calculer le volume ![]() où apparaît la première goutte de liquide.
où apparaît la première goutte de liquide.
1)2) Quel est le travail échangé pendant la compression isotherme
de ![]() à
à ![]() ?
?
1)3) Le volume massique de l’eau liquide étant ![]() ,
calculer la fraction de mole de vapeur d’eau dans l’état
,
calculer la fraction de mole de vapeur d’eau dans l’état ![]() ,
,
![]() .
.
2) Le volume étant fixé à ![]() ,
on élève la température de
,
on élève la température de ![]() à T.
à T.
Sachant que la chaleur latente de vaporisation de l’eau varie
avec la température selon la loi empirique ![]() (
(![]() ),
),
2)1) montrer que, si l’on néglige le volume molaire de l’eau liquide
devant celui de la vapeur saturante, la pression de vapeur saturante est liée
à la température T par une relation de la forme ![]() ,
,
2)2) trouver une relation donnant la température ![]() à laquelle la phase liquide disparait (on calculera une valeur approchée
de
à laquelle la phase liquide disparait (on calculera une valeur approchée
de ![]() en posant
en posant ![]() et en considérant
et en considérant ![]() ).
).
| Réponse 1)1) | Réponse 1)2) | Réponse 1)3) | Réponse 2)1) | Réponse 2)2) |
3 - Les données suivantes se rapportent au benzène
:
- température de fusion sous la pression atmosphérique normale
![]()
- variation du point de fusion avec la pression exprimée en atmosphère
![]()
- coefficient de dilatation du liquide ![]()
- masses volumiques à la température de fusion ![]() ,
,
![]()
- capacité calorifique massique du liquide ![]()
1) Calculer la chaleur latente de fusion ![]() et la variation d’énergie
et la variation d’énergie ![]() interne pendant la fusion à la pression atmosphérique normale.
interne pendant la fusion à la pression atmosphérique normale.
2) On comprime de façon isotherme du benzène liquide à
![]() . Sous quelle pression
. Sous quelle pression
![]() se solidifiera
t’il ?
se solidifiera
t’il ?
3) Le liquide étant, sous la pression atmosphérique normale, à
la température ![]() ,
on le comprime adiabatiquement.
,
on le comprime adiabatiquement.
Calculer la variation de température produite par une augmentation de
pression de 1 atm.
A quelle pression ![]() ,
la solidification commence-t-elle à se produire ?
,
la solidification commence-t-elle à se produire ?
| Réponse 1) | Réponse 2) | Réponse 3) |
4 - On considère un corps pur et on se place
à des températures très inférieures à la
température du point critique.
1)a) Donner, à partir des relations de Clapeyron, une expression simplifiée
de la chaleur latente de vaporisation ![]() .
.
1)b) On assimile la vapeur saturante à un gaz parfait.
Démontrer la formule de Dupré pour la pression de vapeur saturante
:
![]() si, pour l'intervalle
de températures considérées, la chaleur latente de vaporisation
est de la forme
si, pour l'intervalle
de températures considérées, la chaleur latente de vaporisation
est de la forme ![]()
1)c)
Dans quelles conditions, la formule de Dupré se confond avec la formule
de Rankine.
2) Pour l'eau, ![]()
2)a) Calculer la pente de la courbe de vaporisation de l'eau à 100 °C.
La température de l'ébullition de l'eau est-elle sensible
aux variations de pression atmosphérique de la vie courante ?
2)b) Calculer la température d'ébullition de l'eau à une
pression atmosphérique de ![]() .
.
| Réponse 1)a) | Réponse 1)b) | Réponse 1)c) | Réponse 2)a) | Réponse 2)b) |
5 - On considère un système liquide-vapeur
d'eau de masse totale 1 kg, de titre x, c'est à dire constitué
de (1- x) kg d'eau et x kg de vapeur d'eau, en équilibre
à ![]() sous
la pression de vapeur saturante
sous
la pression de vapeur saturante ![]() .
On désigne par
.
On désigne par ![]() la chaleur latente de vaporisation de 1 kg et par
la chaleur latente de vaporisation de 1 kg et par ![]() les volumes massiques de la vapeur saturante et du liquide saturant.
les volumes massiques de la vapeur saturante et du liquide saturant.
On donne les volumes massiques de l'équilibre liquide-vapeur à
373,15 K :
![]()
ainsi que les chaleurs latentes de vaporisation pour différentes températures
:
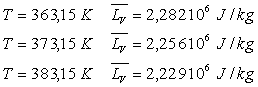
1) Expliquer pourquoi les variables d'état pression
de vapeur saturante ![]() et volume massique
et volume massique ![]() de l'équilibre sont parfaitement déterminées par la donnée
de la température et du titre.
de l'équilibre sont parfaitement déterminées par la donnée
de la température et du titre.
2)a) Ecrire les variations d'enthalpie et d'entropie du système au cours
d'une évolution infinitésimale réversible faisant passer
le système de l'état (T, x) à l'état
(![]() ).
).
On désignera par ![]() les chaleurs massiques respectives du liquide saturant et de la vapeur saturante.
les chaleurs massiques respectives du liquide saturant et de la vapeur saturante.
2)b) En déduire les relations de Clapeyron, à savoir la relation
entre ![]() d'une
part et celle entre
d'une
part et celle entre ![]() .
.
3) Pour quelle valeur particulière ![]() ,
la variation du titre est-elle nulle au cours d'une évolution adiabatique
réversible faisant passer la température de
,
la variation du titre est-elle nulle au cours d'une évolution adiabatique
réversible faisant passer la température de ![]() ?
?
4)a) A.N. On supposera que ![]()
Exprimer à partir des données et pour ![]() :
: ![]()
4)b) On désire justifier ![]() .
Pour cela, exprimer la quantité de chaleur
.
Pour cela, exprimer la quantité de chaleur ![]() échangée au cours d'une transformation infinitésimale réversible
du liquide saturant en fonction de
échangée au cours d'une transformation infinitésimale réversible
du liquide saturant en fonction de ![]() (coefficient de dilatation du liquide à pression constante).
(coefficient de dilatation du liquide à pression constante).
En déduire la valeur de l'écart ![]()
4)c) On désire calculer ![]() à partir de la valeur de
à partir de la valeur de ![]() capacité calorifique massique à pression constante de la vapeur
saturante.
capacité calorifique massique à pression constante de la vapeur
saturante.
Exprimer la quantité de chaleur ![]() échangée au cours d'une transformation infinitésimale réversible
de la vapeur saturante en fonction de
échangée au cours d'une transformation infinitésimale réversible
de la vapeur saturante en fonction de ![]() (coefficient de dilatation de la vapeur à pression constante).
(coefficient de dilatation de la vapeur à pression constante).
En déduire la valeur de ![]() en considérant que la vapeur saturante se comporte comme un gaz parfait
(on justifiera cette approximation).
en considérant que la vapeur saturante se comporte comme un gaz parfait
(on justifiera cette approximation).
Comparer la valeur trouvée de ![]() à celle calculée en 4)a).
à celle calculée en 4)a).
| Réponse 1) | Réponse 2)a) | Réponse 2)b) | Réponse 3) | Réponse 4)a) | Réponse 4)b) | Réponse 4)c) |