CHAPITRE 6 : Le Premier Principe
Plan
1. Notion de conservation de l’énergie
2. Premier Principe de la Thermodynamique
2.1. Modification de l’état d’un système
2.2. Principe d’équivalence
2.3. Energie interne
2.4. Premier Principe de la Thermodynamique pour un système
fermé
2.5. Transferts thermiques
3. Mécanique et Thermodynamique. Principe de conservation
de l’énergie
Annexe : quelques rappels simples
de Mécanique
Tout domaine des Sciences Physiques introduit le concept
d’énergie. Bien que ce concept soit récent (environ deux
siècles), il a largement dépassé le champ de compétences
des Sciences Physiques et il n’est pas exagéré de dire qu’il conditionne
" l’ordonnancement de nos vies sur la planète Terre " :
le moindre " dérèglement " dans l’approvisionnement
énergétique est source de conflits et d’interventions rapides
dans un contexte où beaucoup pensent que le sort de l'aventure humaine
sur la planète Terre va se jouer dans les quelques décennies à
venir.
"Le défi qui nous attend n'est rien d'autre que d'assurer la survie de l'humanité" Mikaël Gorbatchev
1. Notion de conservation de l’énergie.
Le lecteur pourra utiliser avec avantage, si nécessaire,
l’annexe " Quelques rappels simples de Mécanique "
située à la fin du chapitre.
Le mot énergie vient du grec energhia
qui signifie " force en action " c’est à dire
capacité à produire un mouvement.
Ainsi un corps qui possède de l’énergie cinétique
(jadis appelée " force vive ") peut continuer, de
lui-même, son mouvement au moins sur une certaine distance même
dans un milieu résistant (s’opposant au mouvement).
L’énergie potentielle (jadis appelée " force
morte ") a la capacité à produire un mouvement puisque,
spontanément, par exemple, un corps pesant non contraint chute, une particule
chargée q non contrainte à potentiel électrique
V (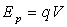 ) se
met en mouvement vers des régions de moindre énergie électrique.
) se
met en mouvement vers des régions de moindre énergie électrique.
En Mécanique, on voit :
- que forces et énergie cinétique apparaissent ensemble dans le théorème de l’énergie cinétique,
- que l’énergie potentielle est liée à la notion de forces conservatives c’est à dire de forces qui conservent l’énergie mécanique.
Très vite, le concept d’énergie mécanique se révèle insuffisant.
Un opérateur exerce une action (force) sur un système
qui acquiert de l’énergie mécanique. Dans un certain nombre de
cas il se trouve que le travail de l’opérateur est égal à
l’énergie mécanique acquise par le système.
Ceci est satisfaisant pour l’esprit humain attaché à la notion
de conservation : l’énergie acquise par le système a été
perdue par l’opérateur qui a pu la transmettre (l’échanger) par
travail.
Comment interpréter si le travail de l’opérateur n’est pas égal
à l’énergie mécanique acquise par le système ?
Ceci se produit lorsqu’il y a " des frottements, des résistances "
et l’énergie mécanique acquise est toujours inférieure
au travail de l’opérateur.
L’ énergie de l’Univers diminue t’elle ? Y a t’il possibilité
d’une création spontanée d’énergie qui compenserait partiellement,
totalement la perte d’énergie, voire la dépasserait ce qui ferait
que l’énergie de l’Univers augmenterait.
La réponse à ces questions constitue le Principe de conservation de l’énergie.
2. Premier Principe de la Thermodynamique
Dans ce paragraphe, nous envisageons des systèmes ne changeant pas d'énergie mécanique (disons immobiles dans le référentiel d'étude)
2.1. Modification de l’état d’un système
par échange d’énergie sous forme de travail de forces d’opérateur extérieur
|
|
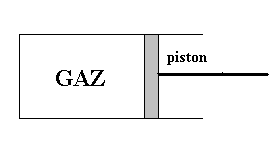
Un gaz est enfermé dans un récipient (cylindre) dont l’une (piston) des parois solides est mobile. Un opérateur extérieur en exerçant une force sur le piston provoque le déplacement de ce dernier et, par exemple, une diminution du volume occupé par le gaz. Il se produira une augmentation de la pression du gaz et, généralement, une variation de la température du gaz. |
L’état du système gaz a changé.
L’opérateur a effectué un travail qui, suivant ce que nous a appris
la Mécanique, est un échange d’énergie entre le système
gaz et l’opérateur extérieur. Cet échange d’énergie
se traduit par une modification des variables d’état.
par transferts thermiques (ou transfert de chaleur ou transfert d’énergie calorifique)
Lorsque nous mettons en "contact" des corps de températures
différentes, nous produisons une modification de l’état de
ces corps (changement des températures et/ou de phases).
L’eau contenue dans une casserole en contact avec la flamme d’un gaz en combustion
voit sa température s’élever puis elle se met à bouillir
c’est à dire elle se transforme en vapeur (gaz).
Nous ne pouvons attribuer ces modifications de l’état du système
à des échanges d’énergie sous forme de travail.
Dans ce cas, nous parlons de transferts thermiques (ou de transfert de chaleur).
Cependant, il ne faudrait pas croire que ces deux façons d’agir sur un système peuvent être totalement équivalentes : par transferts thermiques, nous ne pouvons jamais affecter directement le mouvement d’un système.
2.2. Principe d’équivalence
Nous sommes tout à fait capables d’élever la
température de l’eau contenue dans une casserole en mettant en mouvement
des palettes solides (agitateur). Nous produisons des effets tout à fait
comparables à ceux produits par transferts thermiques mais cette fois
par échange d’énergie sous forme de travail.
Est-ce que les transferts thermiques (la chaleur) sont une autre façon
d’échanger de l’énergie entre différents systèmes
?
La question a été longtemps débattue au 19ème
siècle. La réponse fait partie du Principe d’équivalence
à savoir que travail de forces et chaleur sont les deux seules façons
possibles d’échanger de l’énergie entre systèmes fermés.
Les travaux de J. Joule au siècle dernier ont été déterminants.
Dans un calorimètre (récipient contenant de l’eau dont les parois
peuvent être parfaitement isolées d’un point de vue thermique),
Joule, dans un premier temps, élevait la température par échange
d’énergie sous forme de travail (W était fourni au calorimètre
et compté positivement), dans un deuxième temps, il ramenait le
calorimètre à son état initial en le refroidissant par
échange de chaleur avec l’extérieur (la chaleur Q était
perdue par le calorimètre et compté négativement).
Les mesures de Joule, sur ce cas expérimental, montrèrent que
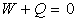
Ce résultat suppose que travail et chaleur soient comptés dans
une même unité.
En fait, avant Joule, les quantités de chaleur étaient comptées
en calories, la calorie étant la quantité de chaleur nécessaire
pour élever 1g d’eau de 14,5 à 15,5 °C sous la pression
atmosphérique normale.
Les expériences de Joule établissent un rapport entre l’unité
travail (appelé actuellement Joule) et l’unité chaleur compris
entre 4,1855 et 4,1860.
1 cal = 4,18 joules
Le résultat 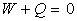 généralisé à tout système constitue le principe
d’équivalence que nous énoncerons ainsi :
généralisé à tout système constitue le principe
d’équivalence que nous énoncerons ainsi :
" Dans une expérience dans laquelle rien n’a varié d’autre
que des quantités de travail et de chaleur échangées avec
l’extérieur, il y a équivalence entre le travail et la chaleur "
ou
" Lorsqu’un système thermodynamique fermé quelconque
subit un cycle de transformations qui le ramène à son état
initial, la somme du travail W et de la chaleur Q échangés
est nulle "
2.3. Energie interne
Définition de l’énergie interne
|
|
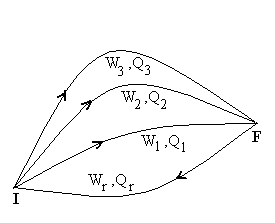
Soit un système fermé évoluant d’un
état I à un état F en échangeant avec l’extérieur
du travail W et de la chaleur Q, sans que son énergie
mécanique change. Imaginons plusieurs transformations notées
1, 2, ... pour aller de l’état I à l’état F et une
transformation r ramenant de l’état F à l’état I.
Nous appliquons le principe d’équivalence pour les différents
cycles, à savoir :
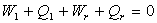 ; ; 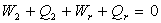 ; ......
; ......
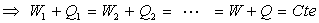
|
La quantité W + Q est indépendante
de la transformation amenant de l’état I à l’état F. Elle
ne dépend donc que des états I et F dont on rend compte par les
variables d’état.
Par définition, la somme W + Q
est la variation de l’énergie interne U du système.
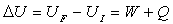
Définie par une variation, l’énergie interne
U n’est connue qu’à une constante additive près. Elle ne
dépend que de l’état du système.
Pour un système en état d’équilibre où les variables
d’état (c’est à dire les paramètres mesurables qui rendent
compte de l’état du système) sont constantes et uniformes, l’énergie
interne est une fonction de celles-ci.
Par définition, on appelle fonction d’état une fonction
des variables d’état.
Aussi l’énergie interne U est une fonction d’état
 U = U(variables d’état)
U = U(variables d’état)
Visualisation de l’énergie interne
Compte tenu de ce que nous savons sur la structure de la matière, de l’énergie cinétique qui ne fait appel qu’à l’aspect macroscopique du système et de l’énergie potentielle qui est le résultat d’interactions avec d’autres systèmes macroscopiques, l’énergie interne est une notion simple qui comprend :
- l’énergie cinétique " microscopique " des particules constituant le système dans un référentiel où les particules sont globalement au repos
- l’énergie des interactions entre particules
- l’énergie de liaison des molécules (énergie chimique)
- l’énergie de liaison des constituants de l’atome (énergie atomique ou nucléaire).
Une propriété importante de l’énergie interne découle de ce propos : l’énergie interne a un caractère additif.
2.4. Premier Principe de la Thermodynamique
pour un système fermé
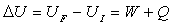
- U énergie interne est une fonction d’état ; sa variation est indépendante de la transformation et ne dépend que des états initial et final.
- L’énergie interne a un caractère additif.
- Le terme W représente le travail de forces produites par un opérateur extérieur qui affectent l’état thermodynamique (variables d’état) du système et Q représente la chaleur. Ce sont les deux façons, pour un système fermé, d’échanger de l’énergie avec d’autres systèmes appelés milieu extérieur.
- Puisqu’il s’agit d’échanges, il serait fondamentalement faux d’attribuer travail et/ou chaleur à un système particulier.
- W et Q dépendent de la transformation qui amène d’un état initial à un état final.
- En cohérence avec la Mécanique, ils sont comptés positivement pour un système s’ils sont reçus par celui-ci, négativement s’ils sont perdus (ou fournis) par le système.
Pour une transformation quasi-statique, entre deux états
d’équilibre infiniment proches, le premier principe s’écrit :
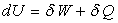
- dU est la variation élémentaire d’une
fonction : mathématiquement, c’est une différentielle totale
exacte,
-  sont des quantités
élémentaires qui ont l’aspect de formes différentielles.
Ce ne sont pas des différentielles totales exactes car les fonctions
W et Q n’existent pas.
sont des quantités
élémentaires qui ont l’aspect de formes différentielles.
Ce ne sont pas des différentielles totales exactes car les fonctions
W et Q n’existent pas.
On notera la différence de notation entre une différentielle
d’une fonction (par exemple 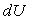 )
et une forme différentielle qui n’est pas différentielle d’une
fonction (par exemple
)
et une forme différentielle qui n’est pas différentielle d’une
fonction (par exemple 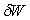 ).
).
Remarque : Très souvent aussi pour les systèmes que nous étudierons (nous ne disons pas pour le milieu extérieur) les variations d’énergie interne se limiteront à des changements d’énergie mécanique microscopique (pas de réactions chimiques ou nucléaires).
2.5. Transferts thermiques
Le transfert thermique (de chaleur) apparaît comme un transfert
d'énergie interne (on dit aussi, au lieu de transfert thermique ou de chaleur,
transfert d'énergie calorifique) lié à des différences de températures.
Il existe trois modes de transfert de chaleur dont les mécanismes internes sont
différents :
- le transfert de chaleur par conduction, régi par la loi de Fourier, est le
mode qui agit dans une matière immobile à l'échelle macroscopique, donc essentiellement
dans les solides ;
- le transfert de chaleur par convection, régi par les lois de Navier-Stokes,
est lié à des mouvements macroscopiques de matière, c'est donc le cas des fluides
; ces mouvements peuvent être naturels (cas des mouvements verticaux résultants
de différences de températures où les températures les plus élevées sont aux
altitudes les plus basses) ou forcés (provoqués par un ventilateur dans un gaz
ou une pompe dans un liquide ;
- le rayonnement thermique, chaque corps émet et absorbe des ondes électromagnétiques
dont l'énergie dépend de la température de surface du corps et de sa nature
; le transfert d'énergie est égal au bilan énergétique d'absorption et d'émission
des ondes électromagnétiques entre deux corps ; le rayonnement thermique se
propage dans le vide et les milieux transparents pour les ondes concernées.
Ce cours de base de Thermodynamique ne fait pas l'étude, même
élémentaire, des lois du transfert thermique c'est à dire des lois liant échanges
de chaleur et différences de températures.
3. Mécanique
et Thermodynamique. Principe de conservation de l’énergie
Nous avions conclu le paragraphe 1 de ce chapitre sur un certain nombre de questions pour lesquelles nous sommes, en mesure, de répondre avec l'introduction du concept d'énergie interne et le principe de conservation de l'énergie.
Dans un référentiel, l'énergie totale
d'un système est égale à 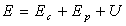
Mécanique et Thermodynamique mettent en évidence les notions d'énergies propres à un système et les possibilités d'échanges d'énergie entre systèmes mais, à ce stade de nos propos, il convient de noter une différence importante entre les deux matière :
- en Thermodynamique, lorsqu’un système reçoit ou perd de l’énergie interne un autre système a fourni ou a reçu cette énergie,
- En Mécanique, il y a possibilité de perte d’énergie mécanique s'il y a frottement.
Notre interrogation, à la fin du paragraphe 1 était : Qu’est devenue cette énergie mécanique perdue ? et la réponse constitue le :
Principe de conservation de l’énergie.
Pour un système dont l’énergie mécanique
et l’énergie interne peuvent varier, nous postulons la conservation de
l’énergie, à savoir
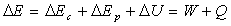
Si nous considérons le frottement entre mobiles,
- en Mécanique, on traduira le frottement par des forces qui affectent le mouvement des mobiles et on déduira les pertes d'énergie mécanique,
- en Thermodynamique, on s'intéressera, à partir de la connaissance des pertes d'énergie mécanique, aux augmentations d'énergie interne des mobiles et aux échanges de chaleur avec un (éventuel) milieu extérieur.
Pour un effet Joule (perte d'énergie potentielle par
frottement dans un système électrique), la Thermodynamique cherchera
à connaître les variations d'énergie interne du système
et ses échanges de chaleur avec un (éventuel) milieu extérieur.
Les échanges de chaleur ne sont possibles que s'il y a des différences
de température entre systèmes en contact thermique. Ces différences
de température sont liées à l'augmentation d'énergie
interne, fonction d'état. Nous verrons qu'à pression constante
(ce qui est le cas d'un nombre important de transformations de notre environnement
quotidien) une augmentation d'énergie interne se traduit par une augmentation
de température.
Aussi, affirmer, comme il est écrit souvent ou comme nous l'entendons
de la part d'éminents collègues que "le travail des forces
de frottement (perte d’énergie mécanique) devient de la chaleur"
nous paraît souvent révélateur d'une méconnaissance
de la notion d'énergie interne.
Cette phrase est vraie dans l'absolu c'est à dire au stade ultime des transformations où les systèmes finissent toujours par se refroidir dans notre environnement et augmenter la température moyenne de la planète Terre.
En résumé,
Toute augmentation (ou diminution) de l'énergie totale (globale) d’un système s’accompagne d’une diminution égale (ou augmentation égale) de l’énergie totale d’autres systèmes.
La création spontanée d’énergie n’existe pas.
Dans notre monde moderne, nous consommons énormément d’énergie interne dans les réactions chimiques (combustion) ou nucléaires. Nous transformons cette énergie dans les moteurs thermiques en énergie mécanique. Nous utilisons cette énergie sous cette forme ou, après transformation, sous forme d’énergie électrique. Une fois utilisée, nous avons une augmentation de l’énergie mécanique microscopique de notre environnement ... inutilisable et la température moyenne de la planète augmente.
Premier principe de la Thermodynamique pour un système ouvert.
La matière contient de l’énergie, il y a donc
une autre possibilité d’échanger de l’énergie : échanger
de la matière. Notre écriture du principe de conservation
de l’énergie n’est donc pas étendue au cas de l’échange
de matière.
Dans le cadre de ce cours, nous n'aborderons pasle transfert d’énergie
accompagnant l’échange de matière c'est à dire les "systèmes
ouverts".
En conséquence, la quantité de matière est enfermée
et donc constante : elle ne peut être considérée comme
une variable de l’état du système.
Nous aurons besoin dans la suite de ce cours de la fonction d’état enthalpie
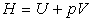 . Cette
fonction nous paraîtra utile, facilitant les calculs. Le sens physique
de l'enthalpie apparaît lors de l'étude des systèmes ouverts
(hors programme)
. Cette
fonction nous paraîtra utile, facilitant les calculs. Le sens physique
de l'enthalpie apparaît lors de l'étude des systèmes ouverts
(hors programme)
Annexe : quelques rappels simples de Mécanique
1. Chute libre
Dans un référentiel galiléen d’origine
O d’axe vertical ascendant Oz, l’étude de la chute libre d’un corps " ponctuel "
M de masse m (en première approximation, il s’agit d’un référentiel
lié au sol, de la chute d’un corps suffisamment dense et de la vitesse
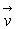 de son centre
de masse) conduit à
de son centre
de masse) conduit à 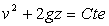 c’est à dire à la conversation de cette quantité au cours
du mouvement (g est l’intensité du champ de pesanteur).
c’est à dire à la conversation de cette quantité au cours
du mouvement (g est l’intensité du champ de pesanteur).
L’interprétation donnée à ce résultat à partir
du principe fondamental de la dynamique est la suivante :
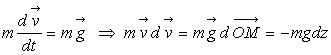 ; par intégration
; par intégration
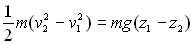 ou encore
ou encore 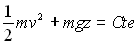
Par définition, 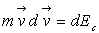 est la différentielle de l’énergie cinétique d’une masse
ponctuelle,
est la différentielle de l’énergie cinétique d’une masse
ponctuelle, 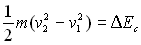 la variation de l’énergie cinétique et
la variation de l’énergie cinétique et  l’énergie cinétique.
l’énergie cinétique.
Les forces de pesanteur sont un cas très particulier. Le travail élémentaire
d’une force est défini, de manière tout à fait générale,
par la relation 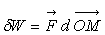 qui, pour la force de pesanteur, devient
qui, pour la force de pesanteur, devient 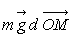 .
L’intégration d’un point M1 à un
point M2 conduit à
.
L’intégration d’un point M1 à un
point M2 conduit à  ,
le travail est indépendant de la trajectoire, il ne dépend que
de la différence d’altitude, des points de départ et d’arrivée.
,
le travail est indépendant de la trajectoire, il ne dépend que
de la différence d’altitude, des points de départ et d’arrivée.
2. Théorème de l’énergie cinétique
L’énergie cinétique se généralise
à un ensemble matériel constituant un système (déformable
ou non) et le théorème de l’énergie cinétique s’écrit
:  où
Wint est le travail des forces intérieures
au système et Wext le travail des forces
extérieures s’appliquant sur le système.
où
Wint est le travail des forces intérieures
au système et Wext le travail des forces
extérieures s’appliquant sur le système.
3. Forces dérivant d’une fonction potentielle (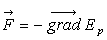 ).
Forces conservatives
).
Forces conservatives
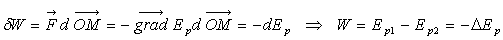 (le travail est indépendant de la trajectoire, il ne dépend que
des points initial et final).
(le travail est indépendant de la trajectoire, il ne dépend que
des points initial et final).
Le théorème de l’énergie cinétique
peut être réécrit ainsi 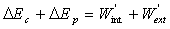 où
W’int et W’ext
sont les travaux des forces intérieures et extérieures ne dérivant
pas d’un potentiel.
où
W’int et W’ext
sont les travaux des forces intérieures et extérieures ne dérivant
pas d’un potentiel.
S’il n’existe que des forces dérivant d’un potentiel,
alors 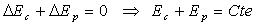
Les forces dérivant d’un potentiel sont appelées forces conservatives
car, au cours du mouvement, elles conservent la quantité 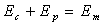 .
.
Ep est appelée énergie
potentielle et Em énergie
mécanique.
Remarque : pour la force de pesanteur, on montrera, sans peine, que
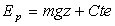
4. Signification des termes " énergie cinétique " et " énergie potentielle "
Le mot énergie vient du grec energhia
qui signifie " force en action " c’est à dire capacité
à produire un mouvement.
Ainsi un corps qui possède de l’énergie cinétique
(jadis appelée " force vive ") peut continuer, de
lui-même, son mouvement au moins sur une certaine distance même
dans un milieu résistant (s’opposant au mouvement).
En quoi l’énergie potentielle (jadis appelée " force
morte ") a t’elle cette capacité à produire un mouvement
?
Reprenons l’exemple de la chute libre. Un corps immobile, non tenu à
une altitude z, spontanément chute et acquiert de l’énergie cinétique.
Il a donc, en lui, une capacité à produire un mouvement, il a
une énergie que nous appelons potentielle c’est à dire susceptible
d’être produite.
5. Forces non conservatives
5.1. Forces d’opérateur extérieur
Comment le corps a t’il acquis cette énergie potentielle
de pesanteur ? Il n’est pas venu à l’altitude z spontanément,
il a fallu un opérateur extérieur pour exercer sur le corps une
force opposée au poids du corps. Pour un corps ponctuel,
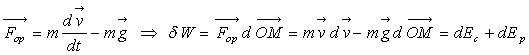
Le travail de la force produite par l’opérateur extérieur
est transformé en énergie cinétique et énergie potentielle.
Le travail de l’opérateur extérieur n’est pas perdu, il a servi
à augmenter l’énergie cinétique et potentielle du corps
: 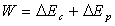
Le travail de l’opérateur extérieur n’a pas
un caractère conservatif puisque la quantité 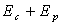 n’est pas conservée. Il s’agit d’une force non conservative.
n’est pas conservée. Il s’agit d’une force non conservative.
Le travail des forces non conservatives doit être compris comme un échange
d’énergie entre deux systèmes. En aucun cas, il ne peut être
considéré comme une énergie de l’un ou de l’autre des systèmes.
Remarque : Si l’intensité de cette force est très légèrement supérieure à celle du poids, alors le corps est porté à l’altitude z à vitesse pratiquement nulle (en Thermodynamique, on parle d’un mouvement fait d’une succession d’états d’équilibre) et le travail de l’opérateur, qui est minimal dans ce cas, est transformé uniquement en énergie potentielle.
5.2. Forces de frottement
Nous envisageons la chute d’un corps dans un milieu résistant (exemple le parachute).
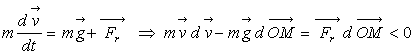 puisqu'une force résistante s’oppose au mouvement.
puisqu'une force résistante s’oppose au mouvement.
En conséquence,  , l’énergie mécanique diminue, elle n’est pas conservée.
, l’énergie mécanique diminue, elle n’est pas conservée.
Il y a perte d’énergie mécanique. Le corps perd de son énergie mécanique pour se mouvoir malgré la force résistante.


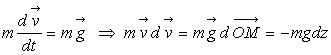 ; par intégration
; par intégration
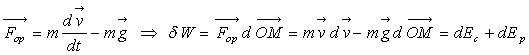
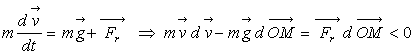 puisqu'une force résistante s’oppose au mouvement.
puisqu'une force résistante s’oppose au mouvement.