Chapitre 5 : Détermination expérimentale des équations d'état
Plan
1. Cas des gaz
2. Cas des solides et des liquides
Cette détermination se fait à partir du tracé
des courbes de compression isotherme dans un diagramme d'Amagat (p, pV)
pour les gaz, voire les liquides ou à partir de la mesure des coefficients
thermoélastiques ![]() définis de la manière suivante :
définis de la manière suivante :
![]() coefficient de dilatation à pression constante
coefficient de dilatation à pression constante
![]() coefficient de compressibilité isotherme
coefficient de compressibilité isotherme
On définit aussi ![]() coefficient d’augmentation de pression à volume constant. On ne mesure
pas ce coefficient pour les liquides ou pour les solides car, empêcher
des variations de volume aussi faibles soient-elles obligerait à exercer
des pressions très importantes. Ce coefficient est connu à partir
de la relation
coefficient d’augmentation de pression à volume constant. On ne mesure
pas ce coefficient pour les liquides ou pour les solides car, empêcher
des variations de volume aussi faibles soient-elles obligerait à exercer
des pressions très importantes. Ce coefficient est connu à partir
de la relation ![]() qui est une conséquence immédiate de l'identité
qui est une conséquence immédiate de l'identité ![]()
|
|
Les premières expériences de compressibilité
isotherme des gaz, dans des domaines de pression très limités
ne dépassant pas quelques atmosphères, ont été
faites au 17ème siècle par
Mariotte en France et par Boyle en Angleterre. |
Ces mesures ont été reprises au 20ème
siècle avec une précision accrue sur tous les gaz connus dans
des domaines de température extrêmes et pour des pressions atteignant
1000 atmosphères.
De longues séries de mesures systématiques ont été
faites dans deux laboratoires spécialisés : en Europe celui de
Van Der Waals à Amsterdam sous la direction de Michels et aux Etats -Unis
au laboratoire du Massachusetts Institute of Technology sous la direction de
Beattie.
Nous présentons, à titre d’exemple, une série de résultats en coordonnées d’Amagat p, pV pour le diazote.
|
|
Au-dessous d’une température (-147 °C pour
le diazote) les courbes sont interrompues car le gaz se liquéfie.
Cette température est appelée température critique
et notée TC . |
Equations d’état des gaz
Il n’existe pas d’équation universelle rendant compte
des courbes ci-dessus.
Pour des valeurs faibles de p, nous devons retrouver l’équation
d’état des gaz parfaits pV=nRT
Des équations classiques sont donc :
![]()
![]()
La validité de ces équations dépend, pour
la précision voulue, essentiellement du domaine de variation de la pression.
Ainsi jusqu’à 2 atmosphères, et même 10 ou 20, on utilise
l’équation d’état des gaz parfaits.
Covolume
L’équation ![]() s’écrit
s’écrit ![]() .
.
Si la pression augmente énormément à une température
donnée, le volume V tend vers la valeur B(T) = nb(T) qui,
suivant l’hypothèse atomique, représente le volume occupé
par les molécules du gaz " entassées " les
unes sur les autres. Ce volume limite est appelé covolume.
Compte tenu de cette interprétation, il est logique que b soit
pratiquement indépendant de la température.
Equation d’état de Van der Waals
|
|
Dans un fluide réel, les interactions entre molécules ne sont plus négligeables et une molécule frappant une paroi est ralentie à l’instant du choc par la présence des autres molécules toutes situées d’un même coté.Ainsi le choc sera moins important que dans le cas du gaz parfait. Le terme p, représentant la pression dans l’équation d’état des gaz parfaits, doit être remplacé par p + p où p est la pression du gaz réel et p un terme devenant nul lorsque la pression tend vers 0 c’est à dire lorsque le comportement du gaz réel tend vers celui du gaz parfait. |
Ainsi, une équation d’état assez générale pour
un fluide réel est ![]() .
.
Ainsi dans l’équation d’état de Van der Waals, et on obtient
![]() avec
avec ![]() (résultats expérimentaux)
(résultats expérimentaux)
Cette équation de Van der Waals interprète la
température de Mariotte.
![]()
Pour ![]() ,
l’équation de Van der Waals s’approche au mieux de l’équation
d’état des gaz parfaits.
,
l’équation de Van der Waals s’approche au mieux de l’équation
d’état des gaz parfaits.
L'équation de Van der Waals interprète aussi
la température critique.
Nous avons vu, lors de l'étude des changements de phases que la courbe
de compression isotherme, pour la température critique, présente
au point critique un point d’inflexion, la tangente y est horizontale.
En ce point, le corps pur obéit :
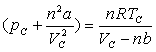 ,
,
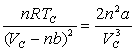
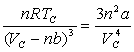
Une interprétation du point critique à partir
de l’équation d’état de Van der Waals ![]() donne :
donne : ![]()
La mesure
des coordonnées du point critique fournit des renseignements sur l’aspect
microscopique de la matière.
On utilise d’autres équations d’état de type Van der Waals, par exemple
Diétérici ![]() ;
Berthelot
;
Berthelot ![]() Clausius
Clausius 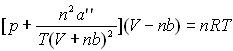
Les équations de Van der Waals, Diétérici, Berthelot ou Clausius peuvent, dans certaines limites, s’appliquer aux liquides.
2. Cas des solides et des liquides
Nous ne décrirons pas les appareillages utilisables
mais invitons le lecteur intéressé à se reporter à
des ouvrages spécialisés.
Pour ce qui est de la connaissance du coefficient de dilatation à pression
constante des solides, on prend des solides en forme de fil et on mesure le
coefficient de dilatation linéaire à pression constante ![]()
Le coefficient de compressibilité isotherme s’obtient à partir des modules de Young, Poisson et/ou de cisaillement mais ceci nécessite des connaissances sur les contraintes dans les solides.
Pour ce qui est de la connaissance du coefficient de dilatation à pression constante des liquides, la mesure se fait directement à partir de l’expérience mise au point par Dulong et Petit ou à l’aide d’un dilatomètre à tige.
La mesure du coefficient de compressibilité isotherme pour les liquides se fait directement dans des piézomètres à capillaire.
Equations d’état des solides et des liquides
Pour les solides et les liquides, les coefficients a
et cT
sont faibles (en première approximation, on les considère comme
indilatables et incompressibles).![]() est une équation d’état habituelle dans des limites de
température et de pression à préciser pour chaque corps.
est une équation d’état habituelle dans des limites de
température et de pression à préciser pour chaque corps.
Cependant pour les liquides, on utilise aussi l’équation d’état de Van der Waals puisque gaz et liquides appartiennent au même état appelé fluide.