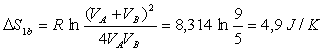L'air au dessus de 200 K est donc un gaz (sa température critique est inférieure à 200 K ; en fait la température critique de l'air est 132,4 K).
Une pression de
A)1) L'équation d'état donnée est celle du gaz
parfait, limite de comportement de tous les gaz réels lorsque la pression
devient nulle.
L'air au dessus de 200 K est donc un gaz (sa température critique
est inférieure à 200 K ; en fait la température
critique de l'air est 132,4 K).
Une pression de ![]() doit être considérée comme une pression relativement faible
puisqu'on peut appliquer l'équation d'état des gaz parfaits.
doit être considérée comme une pression relativement faible
puisqu'on peut appliquer l'équation d'état des gaz parfaits.
A)2) ![]() peut aussi s'écrire
peut aussi s'écrire ![]() ,
soit encore
,
soit encore ![]() puisque
pour un gaz parfait
puisque
pour un gaz parfait ![]() .
.
![]() correspond à
5 degrés de liberté soit, dans le cas des molécules diatomiques
(cas de l'air) aux températures comprises entre 150 K et 1200
K, à 3 degrés de liberté pour le mouvement de translation
du centre de masse et à 2 degrés de liberté pour les deux
rotations possibles.
correspond à
5 degrés de liberté soit, dans le cas des molécules diatomiques
(cas de l'air) aux températures comprises entre 150 K et 1200
K, à 3 degrés de liberté pour le mouvement de translation
du centre de masse et à 2 degrés de liberté pour les deux
rotations possibles.
![]() ð
ð ![]()
![]() ð
ð ![]()
A)3) ![]() ð
ð ![]()
![]()
B)1)a)
![]() puisque le système (A+B) n'échange ni travail (parois indéformables
et immobiles) ni chaleur (parois adiabatiques).
puisque le système (A+B) n'échange ni travail (parois indéformables
et immobiles) ni chaleur (parois adiabatiques).
Le système (A) échange de la chaleur avec le système (B)
: initialement, il y a déséquilibre thermique entre les deux systèmes
ð ![]() ; dans l'état final, il y aura équilibre thermique (principe O
de la Thermodynamique), les deux systèmes auront même température
; dans l'état final, il y aura équilibre thermique (principe O
de la Thermodynamique), les deux systèmes auront même température
![]() . La transformation
est irréversible.
. La transformation
est irréversible.
![]() ð
ð ![]()
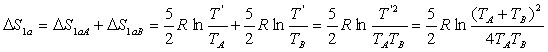 avec
avec ![]()
Si nous écrivons le second principe, ![]() puisque la transformation est adiabatique (pas d'entropie échangée)
et irréversible (entropie créée)
puisque la transformation est adiabatique (pas d'entropie échangée)
et irréversible (entropie créée)
Mathématiquement, montrer que 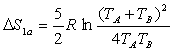 est supérieur à 0 quelques soient
est supérieur à 0 quelques soient ![]() revient à démontrer que
revient à démontrer que 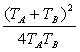 est supérieur à 1, c'est à dire savoir si
est supérieur à 1, c'est à dire savoir si ![]() quelques soient
quelques soient ![]() ,
condition évidemment réalisée.
,
condition évidemment réalisée.
Applications numériques :
![]() ;
; ![]() ;
; ![]()
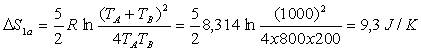
B)1)b) La transformation est irréversible puisqu'il
n'y a pas équilibre mécanique dans l'état initial.
La transformation est isotherme (contact avec la source à température
![]() ).
).
A la fin de la transformation, il y aura équilibre mécanique (pressions
identiques dans les compartiments A et B).
Le volume de chaque compartiment sera ![]() (une même quantité de matière dans les mêmes conditions
de pression et de température occupe un même volume).
(une même quantité de matière dans les mêmes conditions
de pression et de température occupe un même volume).
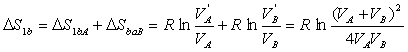
Mathématiquement,
cette quantité est positive pour les mêmes raisons qu'à
la question précédente.
Si on écrit le premier principe, ![]() puisque le système (A+B) n'échange pas de travail.
puisque le système (A+B) n'échange pas de travail.
![]() puisque le système
(A+B) est constitué de gaz parfaits qui ne changent pas de température.
puisque le système
(A+B) est constitué de gaz parfaits qui ne changent pas de température.
Donc, ![]() et l'entropie échangée par le système (A+B) est nulle
et l'entropie échangée par le système (A+B) est nulle
Par suite ![]() puisque la transformation est irréversible.
puisque la transformation est irréversible.
C'est ce que nous avons trouvé à partir de l'expression
mathématique, c'est donc conforme au second principe.
Application numérique :