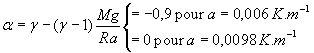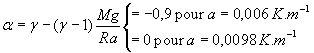II)1)a)
Pour un gaz parfait, une transformation isotherme est aussi une transformation
à énergie interne constante.
Une détente (diminution de pression) suppose un milieu extérieur
à plus faible pression que le système. Le volume du système
augmente, le système pousse sur le milieu extérieur ( ).
).
Pour la détente isotherme réversible d'un gaz parfait, le premier
principe s'écrit :
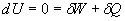 ð
ð
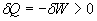 .
.
La détente isotherme s'accompagne d'un échange de chaleur reçu
par le système c'est à dire que le système est en contact
thermique avec une source de chaleur qui fournit au système la quantité
de chaleur nécessaire.
II)1)b)
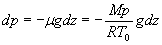 (en introduisant
l'équation d'état du gaz parfait)
(en introduisant
l'équation d'état du gaz parfait)
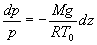 ð
ð
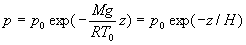 en écrivant
la condition limite
en écrivant
la condition limite 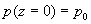
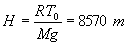
Si 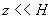 (disons
(disons 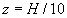 )
alors
)
alors 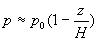
II)2)a)
Pour un gaz parfait, si sa température diminue, son énergie interne
diminue aussi (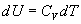 ).
).
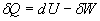 or
or 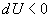 alors que dans la transformation isotherme dU était nul.
alors que dans la transformation isotherme dU était nul.
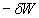 reste positif
: si on admet que cette quantité "ne change pas", alors il convient de
penser que la quantité de chaleur reçue par l'air lorsqu'il se
détend sa température diminuant est plus faible que lorsqu'il
se détend sa température restant constante.
reste positif
: si on admet que cette quantité "ne change pas", alors il convient de
penser que la quantité de chaleur reçue par l'air lorsqu'il se
détend sa température diminuant est plus faible que lorsqu'il
se détend sa température restant constante.
II)2)b)
En introduisant l'équation d'état du gaz parfait, la loi de l'hydrostatique
devient :
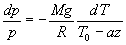 ð
ð
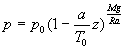
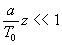 ð
ð
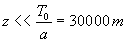 (disons
(disons 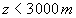 )
)
Sous cette condition 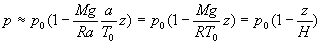
Remarque : le fait de retrouver, en première approximation, la même loi d'évolution de la pression quelque soit l'évolution linéaire de la température avec l'altitude confirme que les échanges de travail restent toujours à peu près les mêmes.
II)3)
La diminution de température correspond, pour un gaz parfait, à
une diminution d'énergie interne. Nous avons vu d'autre part qu'il y
avait apport de chaleur dans la détente du gaz d'autant plus important
que l'on se rapproche de l'isothermicité.
Par suite, dans la relation 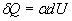 ,
a est négatif, à la limite nul
,
a est négatif, à la limite nul
II)3)a)
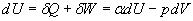
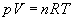 ð
ð
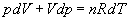
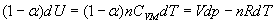 ð
ð
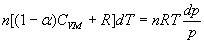
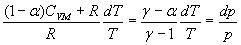
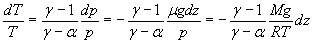 soit
soit 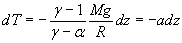
II)3)b)
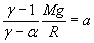 ð
ð