I)1)
L'équation d'état est celle du gaz parfait.
Dans les conditions données pour la température (>132,4 K),
l'air est à l'état gazeux : la température minimale d'un
corps où il ne peut se trouver que dans la phase gazeuse est appelée
température critique.
Le gaz parfait est le comportement limite commun à tous les gaz lorsque
le pression devient "nulle". Expérimentalement, on admet que, pour l'air
jusqu'à des pressions inférieures à 20 bars, l'équation
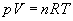 sera applicable
compte tenu de la précision des mesures.
sera applicable
compte tenu de la précision des mesures.
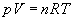 s'écrit aussi
s'écrit aussi 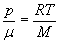 si
on introduit la masse volumique
si
on introduit la masse volumique 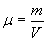 et la masse molaire
et la masse molaire 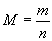 .
.
I)2)
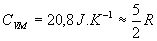
Cette valeur est en accord avec la théorie de l'équipartition
de l'énergie : l'air est principalement constitué de gaz diatomiques
et, aux températures ordinaires, interviennent les trois degrés
de liberté correspondant au mouvement de translation et les deux degrés
de liberté correspondant aux deux seuls mouvements de rotation possibles
pour une molécule diatomique.
5 degrés de liberté donnent une énergie interne molaire
d'origine thermique égale à 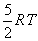 soit une capacité calorifique molaire à volume constant égal
à
soit une capacité calorifique molaire à volume constant égal
à 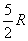 .
.