Exercices de Thermodynamique sur les corps réels
1 - Pression p, température T et
volume V représentent les variables d’état du système
étudié. Elles sont reliées par une équation d’état
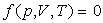 .
.
1) Trouver la relation liant les coefficients thermoélastiques, c’est
à dire le coefficient de dilatation à pression constante 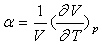 ,
le coefficient d’augmentation de pression à volume constant
,
le coefficient d’augmentation de pression à volume constant 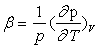 et le coefficient de compressibilité isotherme
et le coefficient de compressibilité isotherme 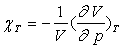
2) Calculer l’accroissement de pression subi par une masse donnée de
mercure lorsqu’on la chauffe de 0 °C à 1 °C à volume
constant en supposant 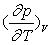 indépendant de T.
indépendant de T.
Application numérique : 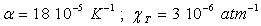
3) Montrer que la température du maximum de densité de l’eau sous
pression donnée est celle pour laquelle 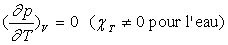
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3) |
2 - Soit un fil élastique de longueur " au
repos " 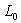 à la température
à la température 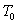 .
Lorsqu’on exerce sur ce fil une traction F, l’expérience montre
que la longueur change et devient L et que la température T
varie.
.
Lorsqu’on exerce sur ce fil une traction F, l’expérience montre
que la longueur change et devient L et que la température T
varie.
1) Justifier la relation  .
.
2) On définit le coefficient de dilatation linéaire à force
constante par 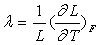 et le module d’Young par
et le module d’Young par 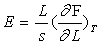 où s est la section du fil.
où s est la section du fil.
Exprimer 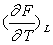 et dF.
et dF.
3)
Pour la substance parfaitement élastique constituant le fil, l’équation
d’état s’écrit 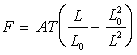 où
A est une constante.
où
A est une constante.
Calculer E et 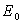 (valeur
de E à traction nulle).
(valeur
de E à traction nulle).
Calculer 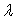 et
et 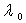 (valeur de
(valeur de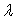 à
traction nulle)
à
traction nulle)
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3) |
3 - Le coefficient de dilatation à pression constante
d’une substance est 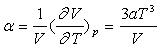 ;
son coefficient de compressibilité isotherme est
;
son coefficient de compressibilité isotherme est 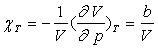 où a et b sont des constantes.
où a et b sont des constantes.
Trouver l’équation d’état 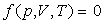 de la substance.
de la substance.
| Méthodologie
| Réponse
|
4 - Un gaz obéit à l’équation de
Van der Waals 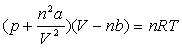
1) Calculer son coefficient de compressibilité isotherme 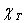 ,
son coefficient de dilatation à pression constante
,
son coefficient de dilatation à pression constante 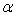 et son coefficient d’augmentation de pression à volume constant
et son coefficient d’augmentation de pression à volume constant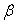 .
.
2) Des mesures ont montré que, pour un gaz réel, les coefficients
de dilatation à pression constante et de compressibilité isotherme
peuvent s’écrire :
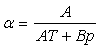 ;
; 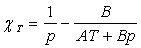
où A et B sont des constantes. En déduire
l’équation d’état. Comparer à celle de Van der Waals.
| Méthodologie
| Réponse
1) | Réponse
2) |
5 - Les variables d’état pression p, volume V et
température T sont reliées par une équation de type
f(p,V,T)=0 appelée équation d’état. On peut aussi
écrire l’équation d’état, par exemple sous la forme p=p(V,T)
où la variable d’état p apparaît alors comme une
fonction des variables indépendantes V et T.
Soient les différentielle totales 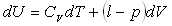 et
et 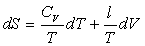 où
où 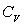 et
et 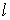 sont les coefficients
calorimétriques qui dépendent des variables d’état.
sont les coefficients
calorimétriques qui dépendent des variables d’état.
1) Expliciter les relations imposées par le fait que 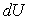 et
et 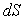 sont des différentielles
totales.
sont des différentielles
totales.
On s’intéresse à l’équation d’état 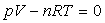 où
où 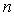 et
et 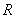 sont des constantes.
sont des constantes.
2) Calculer 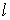 ;
montrer que
;
montrer que 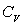 ne
dépend pas de
ne
dépend pas de 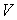 ,
calculer les fonctions d’état
,
calculer les fonctions d’état 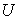 et
et 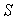 en supposant
que
en supposant
que 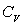 ne dépend
pas de
ne dépend
pas de 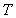 .
.
3) On s’intéresse successivement aux équations d’état 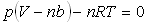 et
et 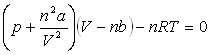 .
.
Reprendre la question 2 avec les mêmes hypothèses.
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3)a) | Réponse
3)b) |
6) Les variables d’état pression p, volume V et
température T sont reliées par une équation de type
f(p,V,T)=0 appelée équation d’état. On peut aussi
écrire l’équation d’état, par exemple sous la forme V=V(p,T)
où la variable d’état V apparaît alors comme une
fonction des variables indépendantes p et T.
Soient les différentielles totales : 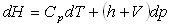 et
et 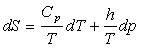 où
où 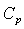 et
et
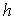 sont les coefficients
calorimétriques qui dépendent des valeurs des variables d’état.
sont les coefficients
calorimétriques qui dépendent des valeurs des variables d’état.
1) Expliciter les relations imposées par le fait que 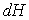 et
et 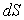 sont des différentielles
totales.
sont des différentielles
totales.
On s’intéresse à l’équation d’état 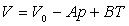 où
où 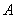 et
et 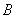 sont des constantes.
sont des constantes.
2) Calculer 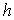 ;
montrer que
;
montrer que 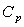 ne
dépend pas de
ne
dépend pas de 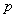 ,
calculer les fonctions d’état
,
calculer les fonctions d’état 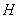 et
et 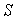 en supposant
que
en supposant
que 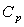 ne dépend
pas de
ne dépend
pas de 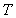 .
.
3) Reprendre la questions 2) avec les mêmes hypothèses et l’équation
d’état 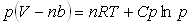 où
où 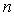 ,
, 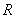 ,
,
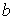 et
et 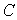 sont des constantes.
sont des constantes.
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3) |
7 - On étudie la compression adiabatique de la
pression 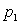 à
la pression
à
la pression 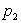 d’un
corps initialement à la température
d’un
corps initialement à la température 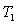 et de volume
et de volume 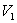 .
.
1) Dans le cas d’une transformation réversible, calculer 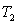 et
et 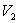 ; calculer le
travail W échangé et l’entropie
; calculer le
travail W échangé et l’entropie 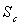 créée.
créée.
2) Dans le cas d’une transformation irréversible (la pression extérieure
est 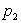 ), calculer
), calculer
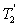 et
et 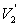 ;
calculer le travail W’ échangé et l’entropie
;
calculer le travail W’ échangé et l’entropie 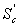 créée.
créée.
3) Comparer W et W’ d’une part, 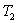 et
et 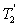 d’autre part.
d’autre part.
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3) |
8 - On étudie la compression isotherme à
la température 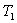 de la pression
de la pression 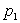 à la pression
à la pression 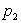 d’un corps initialement de volume
d’un corps initialement de volume 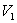 .
.
1) Calculer le volume final 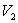 .
.
2) Dans le cas d’une transformation réversible, calculer la chaleur Q
et le travail W échangés, l’entropie 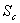 créée.
créée.
3) Dans le cas d’une transformation irréversible (la pression extérieure
étant 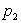 ),
calculer la chaleur Q’ et le travail W’ échangés,
l’entropie
),
calculer la chaleur Q’ et le travail W’ échangés,
l’entropie 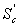 créée.
créée.
4) Comparer W et W’ d’une part, Q et Q’ d’autre
part.
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3) | Réponse
4) |
9 - On étudie la transformation isochore à
volume 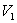 de la pression
de la pression
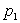 à la pression
à la pression
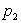 d’un corps initialement
à température
d’un corps initialement
à température 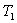 .
.
1) Calculer la température finale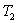 .
.
2) Dans le cas d’une transformation réversible, calculer la chaleur Q,
l’entropie 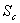 créée.
créée.
3) Dans le cas d’une transformation irréversible (le corps est mis en
contact avec une source à température 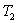 ),
calculer la chaleur Q’, l’entropie
),
calculer la chaleur Q’, l’entropie 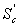 créée.
créée.
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3) |
10 - On étudie la transformation isobare à
pression 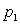 de la
température
de la
température 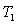 à la température
à la température 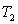 d’un corps initialement au volume
d’un corps initialement au volume 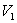 .
.
1) Calculer le volume final 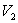 .
.
2) Dans le cas d’une transformation réversible, calculer la chaleur Q
et le travail W, l’entropie 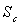 créée.
créée.
3) Dans le cas d’une transformation irréversible (le corps est mis en
contact avec une source à température 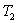 ),
calculer la chaleur Q’ et le travail W’, l’entropie
),
calculer la chaleur Q’ et le travail W’, l’entropie 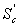 créée.
créée.
| Méthodologie
| Réponse
1 | Réponse
2) | Réponse
3) |
11 - Expérience de Joule Gay-Lussac
Pour les équations d’état de l’exercice 5,
calculer :
2) les variations de température 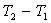 .
.
3) les variations d’entropie 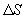 ;
justifier le signe de
;
justifier le signe de 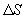 .
.
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3) |
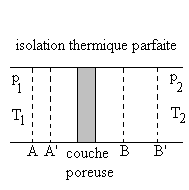
12 - Expérience de Joule Thomson
sections A’ et B’.
1) On se propose de calculer le travail 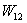 nécessaire pour assurer l’écoulement. On appelle
nécessaire pour assurer l’écoulement. On appelle 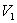 le volume entre les sections A et A’ et
le volume entre les sections A et A’ et 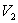 celui entre les sections B et B’.
celui entre les sections B et B’.
En remarquant que le déplacement de A à A’ correspond pour le
système thermodynamique défini ci-dessus à une compression
à pression 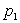 ,
écrire le travail nécessaire à un tel déplacement.
En remarquant que le déplacement de B à B’ correspond pour le
système thermodynamique défini ci-dessus à une détente
à pression
,
écrire le travail nécessaire à un tel déplacement.
En remarquant que le déplacement de B à B’ correspond pour le
système thermodynamique défini ci-dessus à une détente
à pression 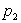 , écrire
le travail nécessaire à un tel déplacement.
, écrire
le travail nécessaire à un tel déplacement.
En déduire le travail 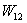 nécessaire pour assurer l’écoulement.
nécessaire pour assurer l’écoulement.
2)1) Ecrire entre les instants 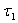 et
et 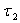 le premier principe
pour le système et montrer que la transformation décrite s’effectue
à enthalpie constante.
le premier principe
pour le système et montrer que la transformation décrite s’effectue
à enthalpie constante.
2)2) En déduire la variation élémentaire de température
dT en fonction de celle de pression dp.
2)3) Que devient cette expression dans le cas du gaz parfait ?
2)4) On considère un gaz de Van der Waals et on se place dans des conditions
telles que 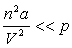 et
et
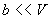 .
.
A l’aide d’un développement limité au 2ème ordre en 1/V
, déduire  .
.
Montrer qu’il existe une température 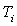 dite température d’inversion telle que dT est positif pour
dite température d’inversion telle que dT est positif pour 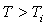 et négatif pour
et négatif pour 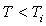 .
.
| Méthodologie
| Réponse
1) | Réponse
2)1) | Réponse
2)2) | Réponse
2)3) | Réponse
2)4) |
13 - On introduit une certaine masse d’éther
liquide dans une ampoule scellée de volume 20 cm3
préalablement vidée. La température pendant l’opération
reste constante et égale à 18 °C. Quelle sera la composition
en masse et volume de l’état d’équilibre final dans les deux cas
suivants :
1) on introduit 10 g d’éther
2) on introduit 0,02 g d’éther
On assimilera la vapeur à un gaz parfait.
On prendra : pression de vapeur saturante de l’éther à 18 °C
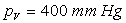 ; masse
volumique de l’éther liquide
; masse
volumique de l’éther liquide 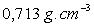 ;
masse molaire de l’éther 74 g.
;
masse molaire de l’éther 74 g.
| Méthodologie
| Réponse
1) | Réponse
2) |
14 - Un cylindre muni d’un piston contient une mole
d’eau M = 18 g à l’état de vapeur. Les parois du
cylindre sont supposées perméables à la chaleur et placées
dans un bain dont on peut régler la température T. On considèrera
la vapeur, même à l’état de vapeur saturante, comme un gaz
parfait.
1) La température étant maintenue à 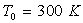 ,
on comprime la vapeur de manière réversible du volume
,
on comprime la vapeur de manière réversible du volume 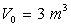 au volume
au volume 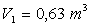 . La
vapeur se trouve alors partiellement liquéfiée, la pression étant
. La
vapeur se trouve alors partiellement liquéfiée, la pression étant
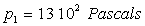 .
.
1)1) Calculer le volume 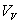 où apparaît la première goutte de liquide.
où apparaît la première goutte de liquide.
1)2) Quel est le travail échangé pendant la compression isotherme
de 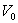 à
à 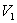 ?
?
1)3) Le volume massique de l’eau liquide étant 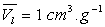 ,
calculer la fraction de mole de vapeur d’eau dans l’état
,
calculer la fraction de mole de vapeur d’eau dans l’état 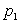 ,
,
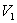 .
.
2) Le volume étant fixé à 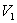 ,
on élève la température de
,
on élève la température de 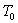 à T.
à T.
Sachant que la chaleur latente de vaporisation de l’eau varie
avec la température selon la loi empirique 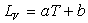 (
(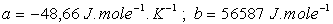 ),
),
2)1) montrer que, si l’on néglige le volume molaire de l’eau liquide
devant celui de la vapeur saturante, la pression de vapeur saturante est liée
à la température T par une relation de la forme 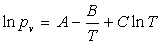 ,
,
2)2) trouver une relation donnant la température 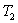 à laquelle la phase liquide disparait (on calculera une valeur approchée
de
à laquelle la phase liquide disparait (on calculera une valeur approchée
de 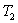 en posant
en posant 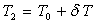 et en considérant
et en considérant 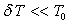 ).
).
| Méthodologie
| Réponse
1)1) | Réponse
1)2) | Réponse
1)3) | Réponse
2)1) | Réponse
2)2) |
15 - Les données suivantes se rapportent au benzène
:
- température de fusion sous la pression atmosphérique normale
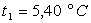
- variation du point de fusion avec la pression exprimée en atmosphère
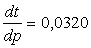
- coefficient de dilatation du liquide 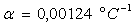
- masses volumiques à la température de fusion 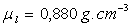 ,
,
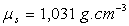
- capacité calorifique massique du liquide 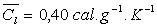
1) Calculer la chaleur latente de fusion 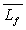 et la variation d’énergie
et la variation d’énergie 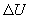 interne pendant la fusion à la pression atmosphérique normale.
interne pendant la fusion à la pression atmosphérique normale.
2) On comprime de façon isotherme du benzène liquide à
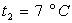 . Sous quelle pression
. Sous quelle pression
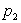 se solidifiera
t’il ?
se solidifiera
t’il ?
3) Le liquide étant, sous la pression atmosphérique normale, à
la température 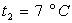 ,
on le comprime adiabatiquement.
,
on le comprime adiabatiquement.
Calculer la variation de température produite par une augmentation de
pression de 1 atm.
A quelle pression 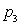 ,
la solidification commence-t-elle à se produire ?
,
la solidification commence-t-elle à se produire ?
| Méthodologie
| Réponse
1) | Réponse
2) | Réponse
3) |
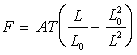 où
A est une constante.
où
A est une constante.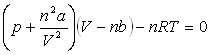 .
.