1) On comprime le gaz de manière réversible de
2) On comprime le gaz de manière irréversible de
Exercices sur les transferts et bilans énergétiques
1 - Un gaz parfait est contenu dans un cylindre fermé
par un piston. On suppose que les parois du cylindre et du piston sont infiniment
perméables à la chaleur de manière que les transformations
étudiées soient isothermes. Les conditions initiales sont ![]() ,
,![]() ,
,![]() .
.
1) On comprime le gaz de manière réversible de ![]() à
à
![]() . Calculer le travail
. Calculer le travail
![]() échangé
au cours de l’opération. Quel est le travail
échangé
au cours de l’opération. Quel est le travail ![]() échangé par le gaz lorsqu’il se détend de manière
réversible de
échangé par le gaz lorsqu’il se détend de manière
réversible de ![]() à
à
![]() . Comparer
. Comparer ![]() et
et ![]() (signe et valeur).
(signe et valeur).
2) On comprime le gaz de manière irréversible de ![]() à
à
![]() en appliquant brutalement
sur la face extérieure du piston la pression
en appliquant brutalement
sur la face extérieure du piston la pression ![]() .
Calculer le travail
.
Calculer le travail ![]() échangé au cours de cette opération. Quel est le travail
échangé au cours de cette opération. Quel est le travail
![]() échangé
par le gaz lorsqu’il se détend de
échangé
par le gaz lorsqu’il se détend de ![]() à
à
![]() , en laissant agir
la pression
, en laissant agir
la pression ![]() sur
la face extérieure du piston. Comparer
sur
la face extérieure du piston. Comparer ![]() et
et ![]() . Comparer
. Comparer ![]() et
et ![]() . On prendra
. On prendra
![]() = 1 atm et
= 1 atm et
![]() = 10 atm
.
= 10 atm
.
| Méthodologie | Réponse 1 | Réponse 2
2 – L’énergie interne U d’un gaz parfait s’obtient à
partir de la relation ![]() .
On considère le cas
.
On considère le cas ![]() .
.
1) Calculer U.
2) Calculer la différentielle dS de l’entropie S du gaz
parfait que l’on exprimera successivement avec le couple de variables (T,
V), (T, p) puis (p, V). Exprimer la fonction
entropie S avec les trois couples de variables.
3) Comment sont affectés les résultats des questions 1) et 2)
si ![]() dépend
de la température.
dépend
de la température.
4)a) Montrer que dans le cas d’une transformation réversible isotherme
à la température ![]() de
la pression
de
la pression ![]() à
la pression
à
la pression ![]() , on
peut calculer les quantités de travail et de chaleur échangées
par le gaz parfait par deux méthodes différentes.
, on
peut calculer les quantités de travail et de chaleur échangées
par le gaz parfait par deux méthodes différentes.
4)b) Comment pourrait-on calculer l’entropie créée ![]() dans le cas d’une transformation isotherme irréversible à température
dans le cas d’une transformation isotherme irréversible à température
![]() , la pression
, la pression ![]() étant appliquée brutalement sur la face extérieure du piston.
étant appliquée brutalement sur la face extérieure du piston.
| Méthodologie | Réponse 1 | Réponse 2 | Réponse 3 | Réponse 4a | Réponse 4b |
3 - Une masse d’air (assimilé à un gaz parfait) ![]() occupe un volume
occupe un volume ![]() la pression atmosphérique
la pression atmosphérique ![]() et à la température
et à la température ![]() .
On la comprime par une opération réversible jusqu’à une
pression
.
On la comprime par une opération réversible jusqu’à une
pression ![]() .
.
1) En supposant que, pendant cette compression, la température du gaz
soit maintenue constante, calculer le travail échangé pour effectuer
la compression. Calculer la variation d’énergie interne et la quantité
de chaleur échangée pendant cette compression.
2) En supposant que la compression soit faite de manière adiabatique,
calculer le volume final et la température finale de l’air. Calculer
le travail échangé, montrer qu’il s’exprime en fonction des températures
finale et initiale. Retrouver ce résultat par la considération
de l’énergie interne.
3) On comprime adiabatiquement le gaz, en partant du même état
initial, jusqu’à une pression p’ , puis on le laisse refroidir
sans changer son volume jusqu’à la température ambiante ![]() .
On veut, après refroidissement, obtenir de l’air à la pression
.
On veut, après refroidissement, obtenir de l’air à la pression
![]() .
.
Calculer la pression p’ , le travail échangé au cours de
la compression adiabatique, ainsi que la chaleur échangée pendant
le refroidissement.
A.N. ![]()
| Méthodologie | Réponse 1 | Réponse 2 | Réponse 3 |
4 - On considère une mole de gaz parfait diatomique initialement
dans l’état 0 (![]() ;
;![]() ;
; ![]() ).
).
On amène ce gaz dans l’état 1 (![]() ;
;![]() ;
; ![]() ) de deux manières
différentes :
) de deux manières
différentes :
a / par compression adiabatique réversible,
b / par compression isotherme réversible jusqu’à la pression ![]() puis échauffement à pression constante jusqu’à la température
puis échauffement à pression constante jusqu’à la température
![]() .
.
1) Représenter les évolutions a / et b / sur
un diagramme (p en ordonnées, V en abscisse)
2) Calculer les travaux ![]() et les quantités de chaleur
et les quantités de chaleur ![]() au cours de chacune des évolutions. Conclusions.
au cours de chacune des évolutions. Conclusions.
| Méthodologie | Réponse 1 | Réponse 2a | Réponse 2b |
5 - On dispose dans un cylindre fermé par un piston une certaine
masse d’un gaz parfait diatomique (![]() ).
Les parois du cylindre et du piston sont isolées et supposées
imperméables à la chaleur. Dans les conditions initiales, le volume
occupé par le gaz est
).
Les parois du cylindre et du piston sont isolées et supposées
imperméables à la chaleur. Dans les conditions initiales, le volume
occupé par le gaz est ![]() ,
la pression est
,
la pression est ![]() et la température
et la température ![]() .
.
1) Calculer la capacité calorifique ![]() relative
à cette masse de gaz.
relative
à cette masse de gaz.
2) On comprime ce gaz de manière réversible jusqu’à ![]() .
.
2)1) Dans quelle(s) condition(s) la réversibilité est-elle réalisée
?
2)2) Calculer ![]() .
.
2)3) Calculer le travail ![]() au cours de l’évolution.
au cours de l’évolution.
3) On comprime maintenant le gaz en partant du même état initial
(![]() ) mais en appliquant
brutalement
) mais en appliquant
brutalement ![]() .
.
3)1) Que peut-on dire de la transformation ?
3)2) Exprimer le travail ![]() échangé
par le système de deux manières différentes.
échangé
par le système de deux manières différentes.
3)3) En déduire la valeur de ![]() en fin d’évolution ainsi que
en fin d’évolution ainsi que ![]() .
Comparer ces résultats à ceux de la question 2). Expliquer la
différence.
.
Comparer ces résultats à ceux de la question 2). Expliquer la
différence.
4) On retire l’isolant thermique qui entourait le cylindre, les parois deviennent
perméables à la chaleur. On réalise un refroidissement
isobare de l’état (![]() )
à l’état (
)
à l’état (![]() ).
).
Calculer la quantité de chaleur échangée au cours de cette
transformation.
| Méthodologie | Réponse 1 | Réponse 2)1) | Réponse 2)2) | Réponse 2)3)| | Réponse 3)1) | Réponse 3)2) | Réponse 3)3) | Réponse 4
6 - Un cylindre indéformable dont les parois sont adiabatiques
contient de l’azote (assimilé à un gaz parfait) réparti
dans deux compartiments A et B séparés par un piston également
adiabatique. Ce piston peut se mouvoir sans frottement. Le compartiment A contient
![]() de gaz, le compartiment
B contient
de gaz, le compartiment
B contient ![]() de gaz.
de gaz.
Dans A, une résistance électrique de capacité calorifique
négligeable permet de chauffer le gaz. La transformation subie par le
gaz du compartiment B est considérée comme réversible.
1) Initialement, la température ![]() et la pression
et la pression ![]() sont les mêmes dans les deux compartiments. Calculer le volume V
du cylindre.
sont les mêmes dans les deux compartiments. Calculer le volume V
du cylindre.
2) A reçoit une quantité de chaleur Q. Ecrire les variations
d’énergie interne du système complet en appelant ![]() la
température finale dans A et
la
température finale dans A et ![]() la température finale dans B. En déduire la pression finale p.
la température finale dans B. En déduire la pression finale p.
3) Que peut-on dire de l’évolution subie par le gaz dans le compartiment
B ?
En déduire ![]() puis
puis ![]() .
.
A.N. ![]() ;
; ![]() ;
; ![]() ;
; ![]()
| Méthodologie | Réponse 1 | Réponse 2 | Réponse 3 |
7 - On désire refroidir une mole de gaz parfait diatomique en
lui faisant subir une suite de compressions isothermes suivies de détentes
adiabatiques. Ce gaz est contenu dans un cylindre fermé par un piston
glissant sans frottement. Initialement, le gaz est à la température
![]() et sa pression
est
et sa pression
est ![]() .
.
Justifier la valeur de ![]() .
.
1) Dans une première opération on comprime le gaz de manière
isotherme réversible jusqu’à la pression ![]() puis on le détend de manière adiabatique réversible jusqu’à
puis on le détend de manière adiabatique réversible jusqu’à
![]() .
.
1)1) Quelle est la température ![]() en fin d’évolution adiabatique ?
en fin d’évolution adiabatique ?
1)2) Calculer la quantité de chaleur ![]() et le travail
et le travail ![]() mis
en jeu au cours de l’évolution isotherme, ainsi que le travail
mis
en jeu au cours de l’évolution isotherme, ainsi que le travail ![]() mis en jeu au cours de l’évolution adiabatique. En déduire le
travail total W reçu par le gaz au cours de cette première
opération.
mis en jeu au cours de l’évolution adiabatique. En déduire le
travail total W reçu par le gaz au cours de cette première
opération.
Calculer la variation d’entropie ![]() au cours de cette première opération.
au cours de cette première opération.
2) Le gaz étant dans l’état ![]() on recommence la même opération (compression isotherme réversible
jusqu’à
on recommence la même opération (compression isotherme réversible
jusqu’à ![]() ,
puis détente adiabatique réversible jusqu’à
,
puis détente adiabatique réversible jusqu’à ![]() ).
).
2)1) Donner l’expression de la température ![]() obtenue à la fin de la nième opération.
obtenue à la fin de la nième opération.
2)2) Pour quelle valeur de n le gaz atteint-il une température ![]() inférieure ou égale à 100K?
inférieure ou égale à 100K?
2)3) Calculer la variation d’entropie ![]() après n opérations.
après n opérations.
3) On suppose maintenant qu’au cours de chaque opération, la compression
isotherme et la détente adiabatique sont irréversibles (pour cela,
on soumet le piston à la pression extérieure ![]() tout au long de l’évolution isotherme puis on le lâche de façon
qu’au cours de la détente adiabatique de
tout au long de l’évolution isotherme puis on le lâche de façon
qu’au cours de la détente adiabatique de ![]() à
à
![]() la pression appliquée
soit constamment la pression atmosphérique
la pression appliquée
soit constamment la pression atmosphérique ![]() ).
).
Calculer le travail ![]() et la chaleur
et la chaleur ![]() mis
en jeu au cours de la première compression isotherme. Comparer à
mis
en jeu au cours de la première compression isotherme. Comparer à
![]() et
et ![]() trouvés en 1)b), expliquer la différence.
trouvés en 1)b), expliquer la différence.
Calculer la température ![]() obtenue à la fin de la première détente adiabatique ainsi
que le travail
obtenue à la fin de la première détente adiabatique ainsi
que le travail ![]() échangé par le gaz au cours de cette détente. Comparer
ces résultats à ceux obtenus quand la détente adiabatique
était réversible. Conclusions ?
échangé par le gaz au cours de cette détente. Comparer
ces résultats à ceux obtenus quand la détente adiabatique
était réversible. Conclusions ?
Calculer la variation d’entropie ![]() après
la première compression isotherme et la première détente
adiabatique. Calculer les entropies créées dans la compression
isotherme et dans la détente adiabatique.
après
la première compression isotherme et la première détente
adiabatique. Calculer les entropies créées dans la compression
isotherme et dans la détente adiabatique.
| Méthodologie
| Réponse
1)1 | Réponse
1)2) | Réponse
2)1) | Réponse
2)2) | Réponse
2)3) | Réponse
3 |
|
8 - Un cylindre de section |
|
Les deux gaz que l’on supposera parfaits sont à la même
température ![]() et le système est en équilibre sous l’action d’une force extérieure
et le système est en équilibre sous l’action d’une force extérieure
![]() s’exerçant
sur P1
.
s’exerçant
sur P1
.
1) Calculer les volumes ![]() et
et ![]() occupés
par chaque gaz.
occupés
par chaque gaz.
2) On modifie lentement la force extérieure ![]() jusqu’à la valeur
jusqu’à la valeur ![]() .
Calculer les volumes
.
Calculer les volumes ![]() et
et ![]() occupés
par chaque gaz ainsi que la température
occupés
par chaque gaz ainsi que la température ![]() et
et ![]() . Quel est le
travail W échangé. Quels sont les travaux
. Quel est le
travail W échangé. Quels sont les travaux ![]() et
et
![]() échangés
par chaque gaz.
échangés
par chaque gaz.
3) Le système étant dans l’état initial (![]() ,
,![]() )
on rend la paroi P2
conductrice et on réalise à nouveau une compression infiniment
lente de
)
on rend la paroi P2
conductrice et on réalise à nouveau une compression infiniment
lente de ![]() à
à
![]() .
.
Que peut-on dire des transformations subies par chaque gaz et par le système
complet ?
Quelle relation lie les paramètres température et pression p
au cours de l’évolution ?
Calculer la température d’équilibre finale ![]() ainsi que les travaux
ainsi que les travaux ![]() ,
,
![]() et W’ échangés
par chaque gaz et par le système dans son ensemble. Comparer ces résultats
à ceux en 2).
et W’ échangés
par chaque gaz et par le système dans son ensemble. Comparer ces résultats
à ceux en 2).
4) Le système étant dans l’état initial (![]() ,
,![]() )
on pratique une ouverture dans la paroi P2
, les deux gaz se mélangent, la paroi P2
est déposée au fond du cylindre et ne joue plus aucun rôle.
On réalise alors la compression infiniment lente de
)
on pratique une ouverture dans la paroi P2
, les deux gaz se mélangent, la paroi P2
est déposée au fond du cylindre et ne joue plus aucun rôle.
On réalise alors la compression infiniment lente de ![]() à
à ![]() .
.
Que peut-on dire des deux phases successives de l’évolution ?
Que peut-on dire de la température d’équilibre finale et du travail
échangé par le système ?
| Méthodologie
| Réponse
1 | Réponse
2 | Réponse
3 | Réponse
4 |
|
9 - Un réservoir indéformable de
volume |
|
Expliquer pourquoi on peut considérer que l’air restant
dans le réservoir s’est détendu de manière adiabatique
quasi-statique. Calculer la température ![]() et la masse
et la masse ![]() de
l’air restant dans le réservoir à la fin de cette détente.
de
l’air restant dans le réservoir à la fin de cette détente.
3) On suppose maintenant que l’on a fait le vide dans le réservoir. On
ouvre brusquement le robinet R, l’air pénètre dans le réservoir
jusqu’à ce que la pression soit égale à la pression extérieure
![]() .
.
3)1) Expliquer la nature de cette opération et donner une expression
littérale du travail W échangé au cours de l’opération
(pour cela, on considérera un système constitué de la quantité
d’air entrant dans le réservoir).
3)2) Calculer la température ![]() de l’air ainsi que le travail W.
de l’air ainsi que le travail W.
4) Le robinet R étant fermé on établit le contact thermique
entre l’intérieur et l’extérieur du réservoir en enlevant
l’isolant qui protégeait les parois. La température de l’air passe
alors de ![]() à
à
![]() . Calculer la chaleur
et le travail échangés.
. Calculer la chaleur
et le travail échangés.
| Méthodologie | Réponse 1 | Réponse 2 | Réponse 3)1) | Réponse 3)2) | Réponse 4 |
|
10 – Un cylindre horizontal est fermé à
l’une de ses extrémités par une paroi fixe F0
et à l’autre l'extrémité par un piston qui peut coulisser
sans frottement le long du cylindre. |
|
2) Les parois du cylindre et le piston sont imperméables
à la chaleur et de capacités calorifiques négligeables.
On perce un orifice dans la paroi fixe F.
Le volume ![]() est suffisamment grand pour que la pression finale soit inférieure à
est suffisamment grand pour que la pression finale soit inférieure à
![]() .
.
2)1) En déduire, dans l’état final, le volume du compartiment
A.
2)2) Calculer par deux méthodes différentes le travail ![]() échangé avec l’extérieur par le gaz. En déduire
la température finale
échangé avec l’extérieur par le gaz. En déduire
la température finale![]() ,
la pression finale
,
la pression finale![]() du
gaz et le volume minimal
du
gaz et le volume minimal ![]() pour que la pression finale
pour que la pression finale![]() reste inférieure à
reste inférieure à ![]() .
.
2)3) Calculer l’entropie ![]() créée.
Le résultat est-il conforme au second principe de la Thermodynamique
?
créée.
Le résultat est-il conforme au second principe de la Thermodynamique
?
3) On revient aux conditions définies en 1), les parois
du cylindre et le piston étant imperméables à la chaleur
et de capacités calorifiques négligeables.
![]() est maintenant
inférieur à
est maintenant
inférieur à ![]() et
la pression finale du gaz sera
et
la pression finale du gaz sera ![]() après avoir percé l’orifice.
après avoir percé l’orifice.
3)1) Calculer par deux méthodes différentes le travail ![]() échangé avec l’extérieur par le gaz. En déduire
la température finale
échangé avec l’extérieur par le gaz. En déduire
la température finale![]() .
.
3)2) Calculer l’entropie ![]() créée.
Le résultat est-il conforme au second principe de la Thermodynamique
?
créée.
Le résultat est-il conforme au second principe de la Thermodynamique
?
4) On revient aux conditions initiales et on bloque le piston. Que se passe
t’il lorsque l’on perce l’orifice ? Conclusions.
| Méthodologie
| Réponse
1 | Réponse
2)1) | Réponse
2)2) | Réponse
2)3) | | Réponse
3)1) | Réponse
3)2) | Réponse
4 |
11 - Expérience de Clément et Desormes
Soit un ballon de volume V muni de deux tubulures, l’une terminée par un robinet, l’autre raccordée à un manomètre rempli d’un liquide de masse volumique m . On néglige le volume des tubulures.
|
A l’instant initial le ballon est rempli d’un gaz parfait
à la température ambiante |
|
On laisse ensuite le système échangé de
la chaleur avec le milieu extérieur de telle sorte que les températures
dans le ballon et à l’extérieur deviennent égales.
2) Donner l’expression de la nouvelle dénivellation h’ du liquide.
En déduire l’expression de g en fonction
de h et h’.
A.N. ![]() ;
;
![]() ;
; ![]()
| Méthodologie | Réponse 1 | Réponse 2 |
12 - On considère un récipient fermé par un piston
de masse ![]() mobile
sans frottements dans le col vertical de section
mobile
sans frottements dans le col vertical de section ![]() d’un récipient.
d’un récipient.
|
Le récipient contient n moles de gaz parfait
dont on cherche à déterminer le rapport |
|
2)2) Soit z la position du piston par rapport à sa position d’équilibre.
Ecrire la variation de volume ![]() du gaz intérieur.
du gaz intérieur.
2)3) Trouver une relation entre les variations de volume ![]() et
et ![]() du gaz intérieur
(ces variations restent faibles devant respectivement V et
du gaz intérieur
(ces variations restent faibles devant respectivement V et ![]() ).
).
2)4) En déduire l’équation différentielle du mouvement
du piston. Donner l’expression théorique de la période ![]() du mouvement. Si
du mouvement. Si ![]() est la période, calculer g .
est la période, calculer g .
2)5) Que deviendraient ces résultats pour des gaz réels ?
| Méthodologie | Réponse 1 | Réponse 2)1) | Réponse 2)2) | Réponse 2)3) | Réponse 2)4) | Réponse 2)5) |
13 - Un cylindre (C), indéformable d’axe horizontal Ox, de section
s, a des parois parfaitement calorifugées. Il est séparé
en deux compartiments par un piston (P), parfaitement calorifugé, de
masse m, mobile sans frottement. Les compartiments 1 et 2 contiennent
chacun une mole de gaz parfait, initialement dans l’état (![]() ). On prendra
). On prendra ![]() constant.
constant.
|
|
Un opérateur extérieur déplace légèrement
le piston et l’abandonne sans vitesse initiale. |
On rappelle que ![]()
| Méthodologie | Réponse 1 | Réponse 2 | Réponse 3 |
14 - Deux systèmes notés 1 et 2, initialement à
température ![]() et
et ![]() , de capacités
calorifiques à pression constante
, de capacités
calorifiques à pression constante ![]() et
et
![]() sont mis en contact
thermique, la pression restant constante au cours de l’évolution. Au
bout d’un temps suffisamment long, il s’établit un état d’équilibre
où les deux systèmes ont même température
sont mis en contact
thermique, la pression restant constante au cours de l’évolution. Au
bout d’un temps suffisamment long, il s’établit un état d’équilibre
où les deux systèmes ont même température ![]() (principe 0).
(principe 0).
1) La transformation est-elle réversible ?
2) Calculer les quantités de chaleur ![]() et
et ![]() échangées
par chacun des systèmes ainsi que la température finale
échangées
par chacun des systèmes ainsi que la température finale ![]() .
.
3) Calculer les variations d’entropie ![]() ,
,
![]() de chacun des
deux systèmes et
de chacun des
deux systèmes et ![]() de l’ensemble des deux systèmes.
de l’ensemble des deux systèmes.
4)1) On se place dans le cas ![]() ,
quels sont les signes de
,
quels sont les signes de ![]() ,
,
![]() et
et ![]() ?
?
4)2) On se place dans le cas ![]() ,
quels sont les signes de ,
,
quels sont les signes de ,![]()
![]() et
et ![]() ?
?
4)3) Onfera l'étude mathématique de ![]() dans le cas
dans le cas ![]()
5) on étudie le cas où le système 2 a une capacité
calorifique " infinie " (atmosphère, eau d’un lac,
...).
Que deviennent les résultats des questions précédentes
? On étudiera mathématiquement ![]() en
fonction de
en
fonction de ![]() .
.
6) Reprendre le texte, les raisonnements et les résultats si les transformations
pour chacun des systèmes sont isochores.
| Méthodologie | Réponse 1 | Réponse 2 | Réponse 3 | Réponse 4)1) | Réponse 4)2) | Réponse 4)3) | Réponse 5 | Réponse 6 |
15 - On considère un cylindre métallique
conducteur de l’électricité, de section ![]() et
de longueur
et
de longueur ![]() . Sa
capacité calorifique est
. Sa
capacité calorifique est ![]() ,
sa masse volumique est
,
sa masse volumique est ![]() ,
sa résistance électrique est
,
sa résistance électrique est![]() ,
sa température initiale est
,
sa température initiale est ![]() .
Les transformations ont lieu à pression constante et on supposera que
le matériau constituant le cylindre est suffisamment bon conducteur de
la chaleur pour que sa température puisse être considérée
comme uniforme.
.
Les transformations ont lieu à pression constante et on supposera que
le matériau constituant le cylindre est suffisamment bon conducteur de
la chaleur pour que sa température puisse être considérée
comme uniforme.
1) On applique aux bornes de ce conducteur une tension ![]() pendant un temps
pendant un temps ![]() ,
tout en le maintenant à la température
,
tout en le maintenant à la température ![]() dans un bain isotherme de même température.
dans un bain isotherme de même température.
1)1) Que peut-on dire de cette opération ?
1)2) Quelle est la nature de l’énergie électrique ? Quelle est
la chaleur échangée par le conducteur ?
1)3) Calculer, pour le conducteur, la variation d’entropie, l’entropie échangée,
l’entropie créée au cours de cette opération.
2) On applique aux bornes de ce conducteur une tension ![]() pendant un temps
pendant un temps ![]() ,
en l’entourant d’une gaine parfaitement imperméable à la chaleur.
,
en l’entourant d’une gaine parfaitement imperméable à la chaleur.
2)1) Quelle est la température finale du conducteur ?
2)2) Calculer, pour le conducteur, la variation d’entropie, l’entropie échangée,
l’entropie créée au cours de cette deuxième opération.
| Méthodologie | Réponse 1)1) | Réponse 1)2) | Réponse 1)3) | Réponse 2)1) | Réponse 2)2) |
16 - On se propose d'étudier un fusible constitué
d'un fil de plomb de longueur l, de rayon r, parcouru par un courant
électrique d'intensité I. La température de fusion
du plomb est égale à ![]() .
.
On rappelle l'expression de la puissance électrique dissipée par
effet Joule ![]() où
où
![]() est la résistivité
électrique du plomb.
est la résistivité
électrique du plomb.
1) Le fusible échange dans de l'air environnant à
température ![]()
Quels modes de transfert de chaleur interviennent dans ces échanges (on
donnera une explication qualitative pour chacun des modes).
2) On rappelle les expressions des densités de flux
de chaleur d'échanges par convection et par rayonnement thermique ![]() et
et ![]() avec
avec ![]() .
.
2)a) Comment appelle t'on la constante ![]() ?
?
2)b) ![]()
Montrer qu'aux températures ordinaires (![]() ),
les échanges par convection sont du même ordre de grandeur que
ceux par rayonnement.
),
les échanges par convection sont du même ordre de grandeur que
ceux par rayonnement.
On utilisera l'identité ![]()
2)c) Comparer à la température de fusion du plomb, les échanges
par convection et ceux par rayonnement.
Calculer la densité de flux de chaleur totale ![]() échangée.
échangée.
3) On désire établir, à la température
de fusion du plomb c'est à dire à la température de "claquage"
du fusible, la relation entre l'intensité I et le rayon r
du fusible.
3)a) A partir d'un bilan thermique où on considère que tout le
fusible est à température ![]() ,
établir la relation liant P,
,
établir la relation liant P, ![]() et la surface latérale du fusible.
et la surface latérale du fusible.
3)b) En déduire la relation liant I et r. Représenter
la courbe ![]() . Quelle
intensité supporte un fusible de rayon
. Quelle
intensité supporte un fusible de rayon ![]() ?
?
| Méthodologie | Réponse 1 | Réponse 2)a) | Réponse 2)b) | Réponse 2)c) | Réponse 3)a) | Réponse 3)b) |
17 - Ailette à section constante semi-infinie
On considère une paroi à température ![]() au contact d’un fluide à température
au contact d’un fluide à température ![]() .
.
1) Exprimer la densité de flux de chaleur ![]() entre la paroi et le fluide
entre la paroi et le fluide
2) On place sur une partie de cette paroi un ailette de section constante (figure
ci-après).
2)1) Etablir, à partir d’un bilan énergétique, l’équation
différentielle qui régit le champ de température permanent
![]() [on considérera
qu’en chaque section
[on considérera
qu’en chaque section ![]() le
champ de température peut, en première approximation, être
pris uniforme].
le
champ de température peut, en première approximation, être
pris uniforme].
2)2) Ecrire les équations aux limites en ![]() et
et ![]() .
.
2)3) Déterminer le champ de température ![]() ;
en déduire le flux de chaleur
;
en déduire le flux de chaleur ![]() échangé entre l’ailette et le fluide.
échangé entre l’ailette et le fluide.
3) En déduire l’efficacité ![]() rapport du flux de chaleur échangé par l ‘ailette au flux
échangé par la paroi sans ailette pour une même section.
rapport du flux de chaleur échangé par l ‘ailette au flux
échangé par la paroi sans ailette pour une même section.
Que deviennent les résultats précédents pour une ailette
semi-infinie de section constante à symétrie de révolution
de rayon R.
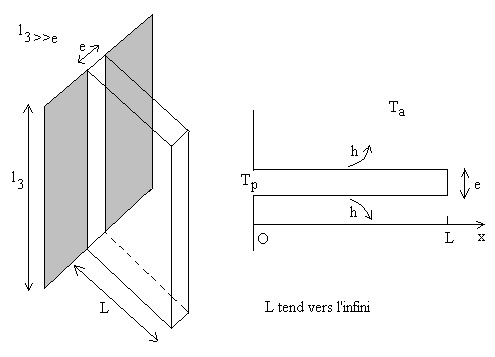
| Méthodologie | Réponse 1 | Réponse 2)1) | Réponse 2)2) | Réponse 2)3) | Réponse 3) |
18 - On linéarise les lois d’échanges de la chaleur par
convection et rayonnement thermique si bien que les densités de flux
de chaleur, respectivement ![]() et
et ![]() ,
sont égales à :
,
sont égales à :
![]() et
et ![]()
où ![]() et
et ![]() sont les coefficients
d’échanges respectivement de convection et de rayonnement, où
sont les coefficients
d’échanges respectivement de convection et de rayonnement, où
![]() est la température
de paroi du corps échangeant,
est la température
de paroi du corps échangeant,
![]() les températures
de référence du milieu environnant.
les températures
de référence du milieu environnant.
Dans tout le problème, on posera ![]() .
.
1) L’étude des phénomènes de convection et de rayonnement thermique conduit, en fait, aux lois suivantes :
![]() et
et ![]()
où ![]() est la constante de Stéfan-Boltzmann et
est la constante de Stéfan-Boltzmann et ![]() le
facteur de forme que nous prendrons dans tout le problème égal
à 1.
le
facteur de forme que nous prendrons dans tout le problème égal
à 1.
Etablir un tableau, pour des valeurs de ![]() égales à
égales à ![]() ,
avec les valeurs de
,
avec les valeurs de ![]() ,
,![]() ,
,
![]() ,
,![]() ,
,![]() et
et ![]() .
.
Comparer les valeurs de ![]() et
et ![]() . Conclusion.
. Conclusion.
2) Un matériel électronique dissipant une puissance
P est enfermé dans une boite métallique en forme de parallélépipède
rectangle de coté ![]() ,
,
![]() et
et ![]() .
.
2)a) Expliquer pourquoi on peut considérer que les parois de la boite
sont à température uniforme notée ![]() .
.
2)b) Chacune des faces de la boite échangeant par convection et rayonnement
conformément à la question 1), compléter le tableau par
les valeurs de P correspondant aux différentes valeurs de ![]() .
.
3) La puissance dissipée étant ![]() ,
la température de paroi
,
la température de paroi ![]() ne pouvant dépasser 343 K, on place des ailettes sur l’une des
faces de dimensions
ne pouvant dépasser 343 K, on place des ailettes sur l’une des
faces de dimensions ![]() ,
,![]() .
.
3)a) Expliquer pourquoi la présence d’ailettes diminue la température
de paroi.
3)b) Pour ![]() et
et ![]() ,
calculer le flux de chaleur que doit évacuer la face avec ailettes (en
fait on calculera le flux de chaleur évacué par les faces sans
ailettes et on déduira celui que doit évacuer la face avec ailettes;
on pourra utiliser les résultats du tableau ou un coefficient
,
calculer le flux de chaleur que doit évacuer la face avec ailettes (en
fait on calculera le flux de chaleur évacué par les faces sans
ailettes et on déduira celui que doit évacuer la face avec ailettes;
on pourra utiliser les résultats du tableau ou un coefficient ![]() ).
).
Comparer ce flux à celui que la face évacue sans ailettes.
3)c) Les ailettes de section rectangulaire (épaisseur e, hauteur ![]() )
sont supposées semi-infinies, la conductivité du matériau
les constituant est
)
sont supposées semi-infinies, la conductivité du matériau
les constituant est ![]() .
.
L’efficacité d’une ailette rectangulaire semi-infinie est égale
à ![]() .
.
Calculer ![]() .
.
En déduire le nombre N d’ailettes nécessaires.
| Méthodologie | Réponse 1 | Réponse 2)a) | Réponse 2)b) | Réponse 3)a) | Réponse 3)b) | Réponse 3)c) |