CHAPITRE 3 : Les Premier et Second Principes
Plan
Le Premier Principe
1. Notion de conservation de l’énergie
2. Premier Principe de la Thermodynamique
2.1. Modification de l’état d’un système
2.2. Principe d’équivalence
2.3. Energie interne
2.4. Premier Principe de la Thermodynamique pour
un système fermé
3. Mécanique et Thermodynamique. Principe de
conservation de l’énergie
Le Second Principe
1. Le Second Principe pour un système fermé
1.1. Enoncé
1.2. Entropie d’un système isolé fermé
1.3. Remarques
1.4. Conséquences mathématiques des
premier et second principes
2. Les énoncés historiques de Clausius
et Thomson
2.1. Enoncé de Clausius
2.2. Enoncé de Thomson
3. Les causes d’irréversibilité
Annexe : quelques rappels simples de Mécanique
Le Premier Principe
Tout domaine des Sciences Physiques introduit le concept d’énergie.
Bien que ce concept soit récent (environ deux siècles), il
a largement dépassé le champ de compétences des Sciences
Physiques et il n’est pas exagéré de dire qu’il conditionne
" l’ordonnancement de nos vies sur la planète Terre " : le moindre
" dérèglement " dans l’approvisionnement énergétique
est source de conflits et d’interventions rapides.
1. Notion de conservation de l’énergie
Le lecteur pourra utiliser avec avantage, si nécessaire, l’annexe
"
Quelques rappels simples de Mécanique " située à
la fin du chapitre.
Le mot énergie vient du grec energhia
qui signifie " force en action " c’est à dire capacité à
produire un mouvement.
Ainsi un corps qui possède de l’énergie cinétique
(jadis appelée " force vive ") peut continuer, de lui-même,
son mouvement au moins sur une certaine distance même dans un milieu
résistant (s’opposant au mouvement).
L’énergie potentielle (jadis appelée " force morte ") a
la capacité à produire un mouvement puisque, spontanément,
par exemple, un corps pesant non contraint chute, une particule chargée
q non contrainte à potentiel électrique V (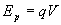 )
se met en mouvement vers des régions de moindre énergie électrique.
)
se met en mouvement vers des régions de moindre énergie électrique.
En Mécanique, on apprend :
- que forces et énergie cinétique apparaissent ensemble
dans le théorème de l’énergie cinétique,
- que l’énergie potentielle est liée à la notion
de forces conservatives c’est à dire de forces qui conservent l’énergie
mécanique.
Très vite, le concept d’énergie mécanique se révèle
insuffisant.
Un opérateur exerce une action (force) sur un système
qui acquiert de l’énergie mécanique. Dans un certain nombre
de cas il se trouve que le travail de l’opérateur est égal
à l’énergie mécanique acquise par le système.
Ceci est satisfaisant pour l’esprit humain attaché à
la notion de conservation : l’énergie acquise par le système
a été perdue par l’opérateur qui a pu la transmettre
(l’échanger) par travail.
Comment interpréter si le travail de l’opérateur n’est
pas égal à l’énergie mécanique acquise par
le système ? Ceci se produit lorsqu’il y a " des frottements, des
résistances " et l’énergie mécanique acquise est toujours
inférieure au travail de l’opérateur.
L’ énergie de l’Univers diminue t’elle ? Y a t’il possibilité
d’une création spontanée d’énergie qui compenserait
partiellement, totalement la perte d’énergie, voire la dépasserait
ce qui ferait que l’énergie de l’Univers augmenterait.
La réponse à ces questions constitue le Principe de
conservation de l’énergie.
2. Premier Principe de la Thermodynamique
2.1. Modification de l’état d’un système
par échange d’énergie sous forme de travail de forces
d’opérateur extérieur
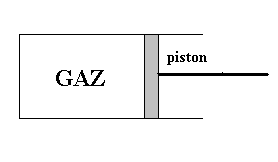 |
Un gaz est enfermé dans un récipient
(cylindre) dont l’une (piston) des parois solides est mobile. Un opérateur
extérieur en exerçant une force sur le piston provoque le
déplacement de ce dernier et, par exemple, une diminution du volume
occupé par le gaz. Il se produira une augmentation de la pression
du gaz et, généralement, une variation de la température
du gaz. |
L’état du système gaz a changé.
L’opérateur a effectué un travail qui, suivant ce que
nous a appris la Mécanique, est un échange d’énergie
entre le système gaz et l’opérateur extérieur. Cet
échange d’énergie se traduit par une modification des variables
d’état.
par transferts thermiques (ou transfert de chaleur ou transfert d’énergie
calorifique)
Lorsque nous mettons en " contact " des corps de températures
différentes, nous produisons une modification de l’état
de ces corps (changement des températures et/ou de phases).
L’eau contenue dans une casserole en contact avec la flamme d’un gaz
en combustion voit sa température s’élever puis elle se met
à bouillir c’est à dire elle se transforme en vapeur (gaz).
Nous ne pouvons attribuer ces modifications de l’état du système
à des échanges d’énergie sous forme de travail.
Dans ce cas, nous parlons de transferts thermiques (ou de transfert
de chaleur).
Cependant, il ne faudrait pas croire que ces deux façons d’agir
sur un système peuvent être totalement équivalentes
: par transferts thermiques, nous ne pouvons jamais affecter directement
le mouvement d’un système.
2.2. Principe d’équivalence
Nous sommes tout à fait capables d’élever la température
de l’eau contenue dans une casserole en mettant en mouvement des palettes
solides (agitateur). Nous produisons des effets tout à fait comparables
à ceux produits par transferts thermiques mais cette fois par échange
d’énergie sous forme de travail.
Est-ce que les transferts thermiques (la chaleur) sont une autre façon
d’échanger de l’énergie entre différents systèmes
?
La question a été longtemps débattue au 19ème
siècle. La réponse fait partie du Principe d’équivalence
à savoir que travail de forces et chaleur sont les deux seules
façons possibles d’échanger de l’énergie entre systèmes
fermés.
Les travaux de J. Joule au siècle dernier ont été
déterminants.
Dans un calorimètre (récipient contenant de l’eau dont
les parois peuvent être parfaitement isolées d’un point de
vue thermique), Joule, dans un premier temps, élevait la température
par échange d’énergie sous forme de travail (W était
fourni au calorimètre et compté positivement), dans un deuxième
temps, il ramenait le calorimètre à son état initial
en le refroidissant par échange de chaleur avec l’extérieur
(la chaleur Q était perdue par le calorimètre et compté
négativement).
Les mesures de Joule, sur ce cas expérimental, montrèrent que 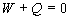
Ce résultat suppose que travail et chaleur soient comptés
dans une même unité.
En fait, avant Joule, les quantités de chaleur étaient
comptées en calories, la calorie étant la quantité
de chaleur nécessaire pour élever 1g d’eau de 14,5
à 15,5 °C sous la pression atmosphérique normale.
Les expériences de Joule établissent un rapport entre
l’unité travail (appelé actuellement Joule) et l’unité
chaleur compris entre 4,1855 et 4,1860.
1 cal = 4,18 joules
Le résultat 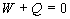 généralisé à tout système constitue le principe
d’équivalence que nous énoncerons ainsi :
généralisé à tout système constitue le principe
d’équivalence que nous énoncerons ainsi :
" Dans une expérience dans laquelle rien n’a varié d’autre
que des quantités de travail et de chaleur échangées
avec l’extérieur, il y a équivalence entre le travail et
la chaleur "
ou
" Lorsqu’un système thermodynamique fermé quelconque
subit un cycle de transformations qui le ramène à son état
initial, la somme du travail W et de la chaleur Q échangés
est nulle "
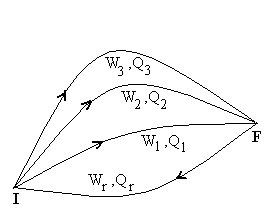
2.3. Energie interne
Définition de l’énergie interne
La quantité W + Q est indépendante de la transformation
amenant de l’état I à l’état F. Elle ne dépend donc
que des états I et F dont on rend compte par les variables d’état.
Par définition, la somme W + Q est la variation
de l’énergie interne U du système soit :
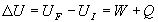
Définie par une variation, l’énergie interne U
n’est connue qu’à une constante additive près. Elle ne dépend
que de l’état du système.
Pour un système en état d’équilibre où
les variables d’état (c’est à dire les paramètres
mesurables qui rendent compte de l’état du système) sont
constantes et uniformes, l’énergie interne est une fonction de celles-ci
: par définition, on appelle fonction d’état une fonction
des variables d’état.
Aussi l’énergie interne U est une fonction d’état 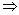 U
= U(variables d’état)
U
= U(variables d’état)
Visualisation de l’énergie interne
Compte tenu de ce que nous savons sur la structure de la matière, de
l’énergie cinétique qui ne fait appel qu’à l’aspect macroscopique
du système et de l’énergie potentielle qui est le résultat
d’interactions avec d’autres systèmes macroscopiques, l’énergie
interne est une notion simple qui comprend :
- l’énergie cinétique " microscopique " des particules constituant
le système dans un référentiel où les particules
sont globalement au repos,
- l’énergie des interactions entre particules,
- l’énergie de liaison des molécules (énergie chimique),
- l’énergie de liaison des constituants de l’atome (énergie atomique
ou nucléaire).
Une propriété importante de l’énergie interne découle
de ce propos : l’énergie interne a un caractère additif.
2.4. Premier Principe de la Thermodynamique pour un système
fermé
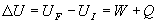
-
U énergie interne est une fonction d’état ; sa variation
est indépendante de la transformation et ne dépend que des
états initial et final.
-
L’énergie interne a un caractère additif.
-
Le terme W représente le travail de forces produites par
un opérateur extérieur qui affectent l’état thermodynamique
(variables d’état) du système et Q représente
la chaleur. Ce sont les deux façons, pour un système fermé
isolé mécaniquement, d’échanger de l’énergie
avec d’autres systèmes appelés milieu extérieur.
-
Puisqu’il s’agit d’échanges, il serait fondamentalement faux
d’attribuer
travail et/ou chaleur à un système particulier.
-
W et Q dépendent de la transformation qui amène
d’un état initial à un état final.
- En cohérence avec la Mécanique, ils sont comptés positivement
pour un système s’ils sont reçus par celui-ci, négativement
s’ils sont perdus (ou fournis) par le système.
Pour une transformation quasi-statique, entre deux états d’équilibre
infiniment proches, le premier principe s’écrit :
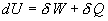
où dU est la variation élémentaire d’une
fonction (mathématiquement, c’est une différentielle totale
exacte),
où  sont
des quantités élémentaires qui ont l’aspect de formes différentielles
(ce ne sont pas des différentielles totales exactes, les fonctions
W et Q n’existent pas).
sont
des quantités élémentaires qui ont l’aspect de formes différentielles
(ce ne sont pas des différentielles totales exactes, les fonctions
W et Q n’existent pas).
On notera la différence de notation entre une différentielle
d’une fonction (par exemple 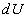 )
et une forme différentielle qui n’est pas différentielle d’une
fonction (par exemple
)
et une forme différentielle qui n’est pas différentielle d’une
fonction (par exemple  ).
).
Remarque : Très souvent pour les systèmes que nous
étudierons (nous ne disons pas pour le milieu extérieur)
les variations d’énergie interne se limiteront à des changements
d’énergie mécanique microscopique (pas de réactions
chimiques ou nucléaires).
3. Mécanique et Thermodynamique.
Principe de conservation de l’énergie
Nous avions conclu le paragraphe 1 de ce chapitre sur un certain nombre de
questions pour lesquelles nous sommes, en mesure, de répondre avec l'introduction
du concept d'énergie interne et le principe de conservation de l'énergie.
Dans un référentiel, l'énergie totale d'un système est égale à 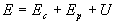
Mécanique et Thermodynamique mettent en évidence les notions d'énergies propres
à un système et les possibilités d'échanges d'énergie entre systèmes mais, à
ce stade de nos propos, il convient de noter une différence importante entre
les deux matière :
- en Thermodynamique, lorsqu'un système reçoit ou perd de l'énergie interne
un autre système a fourni ou a reçu cette énergie,
- En Mécanique, il y a possibilité de perte d'énergie mécanique s'il y a frottement.
Notre interrogation, à la fin du paragraphe 1 était : Qu'est devenue cette
énergie mécanique perdue ?
et la réponse constitue le Principe de conservation de l'énergie.
Pour un système dont l'énergie mécanique et l'énergie interne peuvent varier,
nous postulons la conservation de l'énergie, à savoir
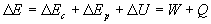
Si nous considérons le frottement entre mobiles,
- en Mécanique, on traduira le frottement par des forces qui affectent le mouvement
des mobiles et on déduira les pertes d'énergie mécanique,
- en Thermodynamique, on s'intéressera, à partir de la connaissance des pertes
d'énergie mécanique, aux augmentations d'énergie interne des mobiles et aux
échanges de chaleur avec un (éventuel) milieu extérieur.
Pour un effet Joule (perte d'énergie potentielle par frottement dans un système
électrique), la Thermodynamique cherchera à connaître les variations d'énergie
interne du système et ses échanges de chaleur avec un (éventuel) milieu extérieur.
Les échanges de chaleur ne sont possibles que s'il y a des différences de température
entre systèmes en contact thermique. Ces différences de température sont liées
à l'augmentation d'énergie interne, fonction d'état. Nous verrons qu'à pression
constante (ce qui est le cas d'un nombre important de transformations de notre
environnement quotidien) une augmentation d'énergie interne se traduit par une
augmentation de température.
Aussi, affirmer, comme il est écrit souvent ou comme nous l'entendons de la
part d'éminents collègues que "le travail des forces de frottement (perte
d'énergie mécanique) devient de la chaleur" nous paraît souvent révélateur
d'une méconnaissance de la notion d'énergie interne.
Cette phrase est vraie dans l'absolu c'est à dire au stade ultime des transformations
où les systèmes finissent toujours par se refroidir dans notre environnement
et augmenter la température moyenne de la planète Terre.
En résumé,
Toute augmentation (ou diminution) de l'énergie totale (globale) d'un système
s'accompagne d'une diminution égale (ou augmentation égale) de l'énergie totale
d'autres systèmes : La création spontanée d'énergie
n'existe pas.
Dans notre monde moderne, nous consommons énormément d'énergie interne dans
les réactions chimiques (combustion) ou nucléaires. Nous transformons cette
énergie dans les moteurs thermiques en énergie mécanique. Nous utilisons cette
énergie sous cette forme ou, après transformation, sous forme d'énergie électrique.
Une fois utilisée, nous avons une augmentation de l'énergie mécanique microscopique
de notre environnement ... inutilisable et la température moyenne de la planète
augmente.
Premier principe de la Thermodynamique pour un système
ouvert.
La matière contient de l’énergie, il y a donc une autre
possibilité d’échanger de l’énergie : échanger
de la matière. Notre écriture du principe de conservation
de l’énergie n’est donc pas étendue au cas de l’échange
de matière.
Dans le cadre de ce cours, nous aborderons le transfert d’énergie
accompagnant l’échange de matière dans le chapitre 6 " Notions
simples sur les systèmes ouverts ".
En conséquence, la quantité de matière est enfermée
et donc constante : elle ne peut être considérée comme
une variable de l’état du système.
Nous aurons besoin dans la suite de ce cours de la fonction d’état enthalpie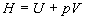 . Cette fonction nous paraîtra utile, facilitant les calculs. Son
sens physique sera donné lors du chapitre 6.
. Cette fonction nous paraîtra utile, facilitant les calculs. Son
sens physique sera donné lors du chapitre 6.
Le Second Principe
Le Second Principe (appelé en France Principe de S. Carnot) est
né, au début de l’ère industrielle entre 1810 et 1860
des réflexions menées sur le fonctionnement des machines
thermiques. En fait, outre S. Carnot, il convient de citer les travaux
de R. Clausius, G.A. Hirn et W. Thomson anobli en Lord Kelvin.
L’expérience montre que certaines transformations qui satisferaient
le Premier Principe ne se produisent pas, par exemple,
- l’énergie thermique se transfère spontanément
du corps chaud vers le corps froid,
- lors du freinage d’une voiture la température des freins s’élèvent
; de l’énergie cinétique a été transférée
sous forme thermique au système de freinage; par contre, il n’est
pas possible de mettre en marche une voiture en prenant de l’énergie
thermique aux freins,
- un système subissant des évolutions cycliques ne peut
transformer de la chaleur en travail (moteur thermique) s’il ne peut être
en contact avec au moins deux milieux extérieurs à températures
différentes,
- etc,
et qu’il est donc nécessaire d’introduire un Second Principe.
Les raisonnements qui ont permis une formulation générale
à partir de ces premières observations sont délicats
et, depuis le milieu du 19ème siècle, il a été
l’objet
de nombreuses recherches, en particulier son interprétation statistique
a largement contribué au développement d’idées apparues
au début du 20ème siècle.
Ainsi actuellement, le Second Principe dépasse largement un
cadre d’applications liées aux machines et nous adopterons une présentation
axiomatique inspirée par les travaux d’I. Prigogine dans les années
1950.
Cette démarche pédagogique fait apparaître les
énoncés de Clausius ou Thomson, le fonctionnement des machines
thermiques comme des conséquences justificatrices de la validité
du Second Principe.
1. Le Second Principe pour un système
fermé
1.1. Enoncé
A tout système est associée une fonction d’état
appelée entropie et notée S.
L’entropie est une grandeur additive.
Au cours d’une transformation d’un système fermé la variation
d’entropie d’un état initial à un état final est égale
à :
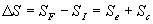
-
 est l’entropie
échangée avec le milieu extérieur. Elle est comptée
positivement si elle est reçue par le système, négativement
dans le cas contraire.
est l’entropie
échangée avec le milieu extérieur. Elle est comptée
positivement si elle est reçue par le système, négativement
dans le cas contraire.
-
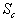 est l’entropie
créée au sein du système.
est l’entropie
créée au sein du système.
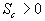 pour les transformations
irréversibles,
pour les transformations
irréversibles,  pour les transformations réversibles.
pour les transformations réversibles.
C’est cette inégalité qui traduit le fait que certaines
transformations ne sont pas possibles.
Contrairement à l’énergie, l’entropie ne se conserve
pas.
Entropie échangée
On appelle source de chaleur tout milieu extérieur envisagé
dans sa capacité à échanger de l’énergie calorifique
(thermique) avec le système.
Remarque : le mot source ne doit surtout pas faire penser que le milieu
extérieur contient de la chaleur ; le milieu extérieur contient
de l’énergie cinétique, potentielle, interne.
Nous limiterons nos propos à des sources de chaleur à
température uniforme.
Si d Q est la quantité de chaleur
échangée par le système entre les instants t et
t + dt avec une source à température TS
, l’entropie d Se
échangée sera : 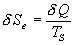
-
Cas d’une source de chaleur à température constante
Le milieu extérieur échange de la chaleur sans changer
de température -milieu extérieur régulé en
température (thermostat) ou à très forte capacité
calorifique (eau d’un lac, d’une rivière, de mer, air atmosphérique,
...-.
Pendant l’intervalle de temps Dt
où système et milieu extérieur sont en contact thermique,
ils échangent une quantité de chaleur Q et une entropie
Se
= Q / TS .
-
Cas de n sources de chaleur à température constante
Soit Qi la quantité de
chaleur échangée par le système avec la source i à
température Ti . Au cours
de la transformation, les sources sont successivement ou en même
temps en contact thermique avec le système.
L’entropie échangée est : 
- Cas d’une transformation réversible
Dans une transformation réversible, le système passe par une
suite continue d’états d’équilibre. Pour s’approcher de cette
condition, il convient qu’à chaque instant l’interaction avec l’extérieur
modifie faiblement l’état d’équilibre existant. Les échanges
de chaleur entre système et sources devront être "peu importants",
donc les températures du système et des sources voisines (notre
sens commun, à défaut de nos connaissances sur le transfert
thermique, nous persuade que les échanges de chaleur augmente avec
les différences de températures).
Dans le cas idéal de la transformation réversible, les températures
du système et des sources sont identiques.
Cette relation, égalité des températures entre système
et milieu extérieur, traduit la condition d’équilibre
pour un système en interaction thermique.
Si, entre les instants t et t + dt, d
Q est la quantité de chaleur échangée avec
la (les) source(s), T la température commune, alors d
Se = d Q
/ T.
Comme Sc = 0, on obtient 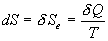 ,
ou en intégrant
,
ou en intégrant 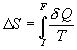 .
.
Remarque : l’unité légale de mesure de l’entropie est le
Joule/Kelvin (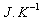 ).
).
1.2. Entropie d’un système isolé
fermé
Un système isolé hors d’équilibre évolue
vers un état d’équilibre " naturel ou non-contraint ", c’est
à dire vers un état d’équilibre qui n’est pas imposé
par l’action du milieu extérieur.
L’écriture du second principe montre que l’entropie est maximale
puisque celle-ci augmente pendant l’évolution vers l’état
d’équilibre.
Ce résultat, à savoir l’existence d’une fonction dont
la valeur est extrémale à l’équilibre est d’une
portée générale en Physique.
Deux fois déjà, dans vos études, cette notion
a été abordée :
- en Optique géométrique où vous avez appris que,
suivant le Principe de Fermat, le chemin optique est extrémal, c’est
à dire que le temps mis par la lumière dans le sens de propagation
pour aller d’un point à un autre est minimal,
- en Mécanique où, pour un équilibre stable c’est
à dire naturel, l’énergie potentielle est minimale.
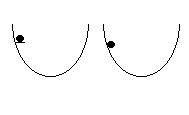 |
L’exemple ci-contre nous aide à mieux
comprendre. Dans la cuvette de gauche, il y a un taquet et la bille est
en équilibre contraint. Dans la cuvette de droite, il n’y a pas
de taquet et la position d’équilibre naturel de la bille est la
position la plus basse où son énergie potentielle est moindre
que dans l’équilibre contraint. |
On remarquera que, sans frottement c’est à dire sans perte d’énergie
mécanique, la bille ne se stabilisera pas à sa position d’équilibre
naturel.
1.3. Remarques
-
l’utilisation de fonctions extrémales à l’équilibre
(et leur définition suivant les conditions de l'équilibre)
est importante en Thermodynamique ; néanmoins, nous estimons que
leur introduction dans ce cours serait trop ambitieuse pour un " premier
contact " avec cette matière.
-
on entend et on lit, parfois sans justificatifs, beaucoup de choses sur
l’entropie, par exemple :
- l’entropie de l’Univers croît ce qui entraînerait sa
mort thermique,
- l’entropie est une mesure du désordre.
La démarche scientifique implique de la rigueur et le professeur
doit se donner les moyens pour expliquer, pour faire comprendre sachant
parfaitement que tout ne sera pas assimilé ... sinon il vaut mieux
savoir dire que certaines questions ne peuvent être exigées,
sont d’un niveau supérieur.
Nous traiterons de cas " en attente " le premier exemple.
Le second exemple est fondamental en Physique mais, pour aborder
cette question, il faut des connaissances certaines de Thermodynamique
statistique, il faut être capable de comprendre ce qu’est un état
quantique, être capable de compter les états microscopiques
correspondant à un même état macroscopique, ... : dans
le cadre de l’enseignement de la Physique en DEUG A, la commission des
programmes estime que cet enseignement est difficile et qu’il convient
d’attendre le 2ème cycle, c’est à dire le niveau
licence.
1.4. Conséquences mathématiques des
premier et second principes
Nous avons introduit deux fonctions d’état U et S (trois
avec l’enthalpie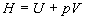 mais cette dernière se déduit directement de U ou inversement)
, leurs variations sont indépendantes de la transformation et ne dépendent
que des états initial et final.
mais cette dernière se déduit directement de U ou inversement)
, leurs variations sont indépendantes de la transformation et ne dépendent
que des états initial et final.
Nous disposons de deux méthodes pour calculer ces variations,
- connaître une transformation quelconque entre état initial
et état final et faire le calcul,
- connaître les fonctions d’état et exprimer leurs variations.
Connaissance de U (ou H) et S
Nous apprendrons que les formes différentielles d
W
+ d
Q et dQ/
T d’un système sont connues.
Ces formes différentielles sont respectivement, selon les premier
et second principes, les différentielles dU et dS
des fonctions U et S.
Les Mathématiques nous apprennent que des formes différentielles
de ce type sont des différentielles totales exactes qui possèdent
des propriétés remarquables, en particulier celle d’obéir
au critère de Cauchy.
Le lecteur intéressé par l’aspect mathématique
de la Thermodynamique peut, dès à présent, se reporter
au chapitre 7 " Propriétés de la matière " en s’appuyant
sur l’annexe " Eléments de Mathématiques " en fin du polycopié.
Calcul de Sc
Ce calcul ne peut être fait qu’à partir de 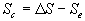 .
.
2. Les énoncés historiques
de Clausius et Thomson
2.1. Enoncé de Clausius
" La chaleur ne passe pas spontanément d’un corps froid sur un
corps chaud "
Considérons un système 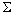 isolé
thermiquement constitué de deux sous-systèmes
isolé
thermiquement constitué de deux sous-systèmes  et
et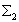 de températures
respectives
de températures
respectives 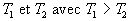 échangeant entre eux uniquement de l’énergie thermique.
échangeant entre eux uniquement de l’énergie thermique.
Nous nous plaçons entre les instants t et 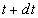 où nous pouvons considérer
où nous pouvons considérer 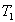 et
et 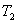 fixées,
nous notons
fixées,
nous notons 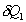 et
et 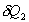 les échanges
de chaleur respectivement aux systèmes
les échanges
de chaleur respectivement aux systèmes  et
et 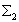 .
.
L’isolation thermique de 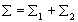 conduit à
conduit à  et à
et à 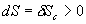 puisque le système
puisque le système 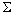 n’échange pas de chaleur.
n’échange pas de chaleur.
Le caractère additif de l’entropie permet d’écrire aussi 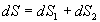
Le calcul de 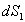 ou
ou 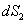 ne nécessite
pas de connaître la transformation, il convient de respecter état
initial et état final.
ne nécessite
pas de connaître la transformation, il convient de respecter état
initial et état final.
Ainsi pour le système 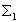 (ou
(ou 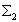 ) à
température
) à
température (ou
(ou  ), nous
pouvons imaginer qu’il a échangé
), nous
pouvons imaginer qu’il a échangé 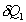 (ou
(ou 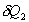 ) dans
une transformation réversible c’est à dire avec une source à
température
) dans
une transformation réversible c’est à dire avec une source à
température  (ou
(ou  ).
).
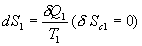 et
et 
Soit 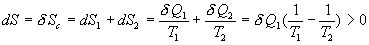
ce qui entraîne 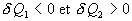 .
.
La chaleur passe spontanément du corps chaud sur le corps
froid.
Remarque : nous aurions pu raisonner à partir du seul système 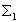 (ou du seul système
(ou du seul système 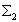 )
et nous aurions trouvé, évidemment, des résultats identiques
; par contre nous ne sommes pas capable d’affecter l’entropie créée
par irréversibilité, l’exercice du mur (voir ci-après dans
le paragraphe 3) montre que cette entropie d’irréversibilité est
principalement créée dans le système " séparant
" les systèmes
)
et nous aurions trouvé, évidemment, des résultats identiques
; par contre nous ne sommes pas capable d’affecter l’entropie créée
par irréversibilité, l’exercice du mur (voir ci-après dans
le paragraphe 3) montre que cette entropie d’irréversibilité est
principalement créée dans le système " séparant
" les systèmes 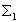 et
et 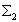 .
.
2.2. Enoncé de Thomson
" Un système en contact avec une seule source de chaleur ne peut,
au cours d’un cycle, que recevoir du travail et fournir de la chaleur "
Le premier principe s’écrit 0 = W + Q
Le second principe s’écrit 0 = Q / TS
+ Sc ce qui entraîne 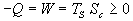
Généralement, on exprime ce résultat par la phrase :
"avec une seule source de chaleur, on ne peut réaliser une machine
thermique motrice".
3. Les causes d’irréversibilité
Exemple d’irréversibilité : le transfert thermique
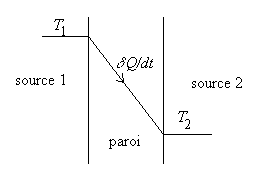 |
Une source de chaleur 1 à température
constante T1 fournit de la chaleur
à une source de chaleur 2 à température constante
T2
(T1 > T2
). Le contact thermique est assuré par une simple paroi solide.
Si les deux sources sont des fluides nous sommes dans le cas d’un échangeur.
Nous nous situons en régime permanent et considérons
comme système la paroi. Ce système est en état de
déséquilibre, cependant les variables d’état gardent
des valeurs constantes en chaque point. |
Par suite la variation d’entropie au cours du temps sera nulle (DS
= 0). Le système échange de la chaleur, donc de l’entropie,
avec chacune des sources. Il reçoit, par unité de temps,
l’énergie calorifique dQ / dt
de la part de la source à température T1
qu’il perd avec celle à température T2
.
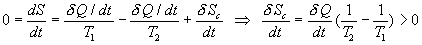
Le transfert thermique qui a lieu spontanément des parties
chaudes vers les parties froides est une cause importante d’irréversibilité.
Les causes d’irréversibilité
-
En l’absence de champs extérieurs, la non-uniformité de grandeurs
telles que la densité des particules, la pression, la température,
... sont des causes d’irréversibilité
-
Les travaux des forces qui se transforment systématiquement en énergie
interne et/ou en chaleur sont des causes d’irréversibilité.
Il s’agit de forces de frottement visqueux, ou solide, d’effet joule, de
" frottement chimique ".
Souvent une notion de " lenteur ou de non-brutalité " est
associée aux transformations réversibles.
L’échelle de temps peut être très différente
suivant la cause d’irréversibilité. Ainsi les phénomènes
où les gradients de température sont cause d’irréversibilité
sont particulièrement lents par rapport à ceux où
sont impliqués les gradients de pression.
Annexe : quelques rappels simples
de Mécanique
1. Chute libre
Dans un référentiel galiléen d’origine O d’axe vertical
ascendant Oz, l’étude de la chute libre d’un corps " ponctuel " M de
masse m (en première approximation, il s’agit d’un référentiel
lié au sol, de la chute d’un corps suffisamment dense et de la vitesse  de son centre de masse) conduit à
de son centre de masse) conduit à  c’est à dire à la conversation de cette quantité au cours
du mouvement (g est l’intensité du champ de pesanteur).
c’est à dire à la conversation de cette quantité au cours
du mouvement (g est l’intensité du champ de pesanteur).
L’interprétation donnée à ce résultat à
partir du principe fondamental de la dynamique est la suivante :
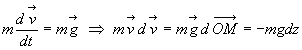 ; par intégration
; par intégration 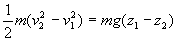
ou encore 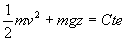
Par définition, 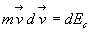 est la différentielle de l’énergie cinétique d’une masse
ponctuelle,
est la différentielle de l’énergie cinétique d’une masse
ponctuelle, 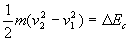 la variation de l’énergie cinétique et
la variation de l’énergie cinétique et 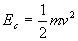 l’énergie cinétique.
l’énergie cinétique.
Les forces de pesanteur sont un cas très particulier. Le travail élémentaire
d’une force est défini, de manière tout à fait générale,
par la relation 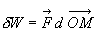 qui, pour la force de pesanteur, devient
qui, pour la force de pesanteur, devient 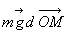 .
.
L’intégration d’un point M1 à
un point M2 conduit à 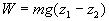 ,
le travail est indépendant de la trajectoire, il ne dépend que
de la différence d’altitude, des points de départ et d’arrivée.
,
le travail est indépendant de la trajectoire, il ne dépend que
de la différence d’altitude, des points de départ et d’arrivée.
2. Théorème de l’énergie cinétique
L’énergie cinétique se généralise à un ensemble
matériel constituant un système (déformable ou non) et
le théorème de l’énergie cinétique s’écrit
: 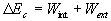 où
Wint est le travail des forces intérieures
au système et Wext le travail des forces
extérieures s’appliquant sur le système.
où
Wint est le travail des forces intérieures
au système et Wext le travail des forces
extérieures s’appliquant sur le système.
3. Forces dérivant d’une fonction potentielle (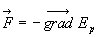 ).
Forces conservatives
).
Forces conservatives
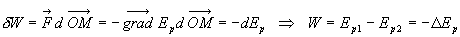 (le travail
est indépendant de la trajectoire, il ne dépend que des points
initial et final).
(le travail
est indépendant de la trajectoire, il ne dépend que des points
initial et final).
Le théorème de l’énergie cinétique peut être
réécrit ainsi 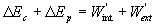 où
W’int et W’ext
sont les travaux des forces intérieures et extérieures ne dérivant
pas d’un potentiel.
où
W’int et W’ext
sont les travaux des forces intérieures et extérieures ne dérivant
pas d’un potentiel.
S’il n’existe que des forces dérivant d’un potentiel, alors 
Les forces dérivant d’un potentiel sont appelées forces conservatives
car, au cours du mouvement, elles conservent la quantité 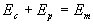 .
.
Ep est appelée énergie
potentielle et Eménergie
mécanique.
Remarque : pour la force de pesanteur, on montrera, sans peine, que 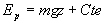
4. Signification des termes " énergie cinétique
" et " énergie potentielle "
Le mot énergie vient du grec energhia
qui signifie " force en action " c’est à dire capacité à
produire un mouvement.
Ainsi un corps qui possède de l’énergie cinétique
(jadis appelée " force vive ") peut continuer, de lui-même,
son mouvement au moins sur une certaine distance même dans un milieu
résistant (s’opposant au mouvement).
En quoi l’énergie potentielle (jadis appelée "
force morte ") a t’elle cette capacité à produire un mouvement
?
Reprenons l’exemple de la chute libre. Un corps immobile, non tenu
à une altitude z, spontanément chute et acquiert de l’énergie
cinétique. Il a donc, en lui, une capacité à produire
un mouvement, il a une énergie que nous appelons potentielle c’est
à dire susceptible d’être produite.
5. Forces non conservatives
5.1. Forces d’opérateur extérieur
Comment le corps a t’il acquis cette énergie potentielle de pesanteur
? Il n’est pas venu à l’altitude z spontanément, il a fallu
un opérateur extérieur pour exercer sur le corps une force
opposée au poids du corps. Pour un corps ponctuel,
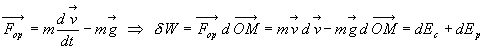
Le travail de la force produite par l’opérateur extérieur
est transformé en énergie cinétique et énergie
potentielle.
Le travail de l’opérateur extérieur n’est pas perdu,
il a servi à augmenter l’énergie cinétique et potentielle
du corps.
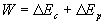
Le travail de l’opérateur extérieur n’a pas un caractère
conservatif puisque la quantité 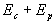 n’est
pas conservée. Il s’agit d’une force non conservative.
n’est
pas conservée. Il s’agit d’une force non conservative.
Le travail des forces non conservatives doit être compris comme
un échange d’énergie entre deux systèmes. En
aucun cas, il ne peut être considéré comme une énergie
de l’un ou de l’autre des systèmes.
Remarque : Si l’intensité de cette force est très
légèrement supérieure à celle du poids, alors
le corps est porté à l’altitude z à vitesse pratiquement
nulle (en Thermodynamique, on parle d’un mouvement fait d’une succession
d’états d’équilibre) et le travail de l’opérateur,
qui est minimal dans ce cas, est transformé uniquement en énergie
potentielle.
5.2. Forces de frottement
Nous envisageons la chute d’un corps dans un milieu résistant
(exemple le parachute).
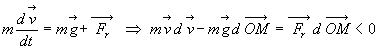 puisqu' une force
résistante s’oppose au mouvement.
puisqu' une force
résistante s’oppose au mouvement.
En conséquence, 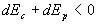 , l’énergie mécanique diminue, elle n’est pas conservée.
, l’énergie mécanique diminue, elle n’est pas conservée.
Il y a perte d’énergie mécanique. Le corps perd de son
énergie mécanique pour se mouvoir malgré la force
résistante.

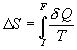 .
.

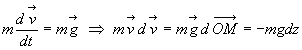 ; par intégration
; par intégration 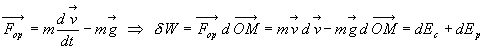
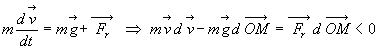 puisqu' une force
résistante s’oppose au mouvement.
puisqu' une force
résistante s’oppose au mouvement.