L’énergie et sa conservation
Plan
1. Notion de conservation de l'énergie
2. Premier Principe de la Thermodynamique
2.1. Modification de l'état d'un système
2.2. Principe d'équivalence
2.3. Energie interne
2.4. Premier Principe de la Thermodynamique pour un
système fermé
3. Mécanique et Thermodynamique. Principe de
conservation de l'énergie
Tout domaine des Sciences Physiques introduit le concept d’énergie.
Bien que ce concept soit récent (environ deux siècles), il
a largement dépassé le champ de compétences des Sciences
Physiques et il n’est pas exagéré de dire qu’il conditionne
" l’ordonnancement de nos vies sur la planète Terre " : le moindre
" dérèglement " dans l’approvisionnement énergétique
est source de conflits et d’interventions rapides.
1. Notion de conservation de l’énergie
Le mot énergie vient du grec energhia
qui signifie " force en action " c’est à dire capacité à
produire un mouvement.
Ainsi un corps qui possède de l’énergie cinétique
(jadis appelée " force vive ") peut continuer, de lui-même,
son mouvement au moins sur une certaine distance même dans un milieu
résistant (s’opposant au mouvement).
L’énergie potentielle (jadis appelée " force morte ") a
la capacité à produire un mouvement puisque, spontanément,
par exemple, un corps pesant non contraint chute, une particule chargée
q non contrainte à potentiel électrique V (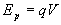 )
se met en mouvement vers des régions de moindre énergie électrique.
)
se met en mouvement vers des régions de moindre énergie électrique.
En Mécanique, on voit :
- que forces et énergie cinétique apparaissent ensemble
dans le théorème de l’énergie cinétique,
- que l’énergie potentielle est liée à la notion
de forces conservatives c’est à dire de forces qui conservent l’énergie
mécanique.
Très vite, le concept d’énergie mécanique se révèle
insuffisant.
Un opérateur exerce une action (force) sur un système
qui acquiert de l’énergie mécanique. Dans un certain nombre
de cas il se trouve que le travail de l’opérateur est égal
à l’énergie mécanique acquise par le système.
Ceci est satisfaisant pour l’esprit humain attaché à
la notion de conservation : l’énergie acquise par le système
a été perdue par l’opérateur qui a pu la transmettre
(l’échanger) par travail.
Comment interpréter si le travail de l’opérateur n’est
pas égal à l’énergie mécanique acquise par
le système ? Ceci se produit lorsqu’il y a " des frottements, des
résistances " et l’énergie mécanique acquise est toujours
inférieure au travail de l’opérateur.
L’ énergie de l’Univers diminue t’elle ? Y a t’il possibilité
d’une création spontanée d’énergie qui compenserait
partiellement, totalement la perte d’énergie, voire la dépasserait
ce qui ferait que l’énergie de l’Univers augmenterait ?
La réponse à ces questions constitue le Principe de
conservation de l’énergie.
2. Premier Principe de la Thermodynamique
2.1. Modification de l’état d’un système
par échange d’énergie sous forme de travail de forces
d’opérateur extérieur
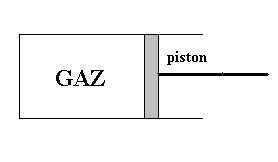 |
Un gaz est enfermé dans un récipient
(cylindre) dont l’une (piston) des parois solides est mobile. Un opérateur
extérieur en exerçant une force sur le piston provoque le
déplacement de ce dernier et, par exemple, une diminution du volume
occupé par le gaz. Il se produira une augmentation de la pression
du gaz et, généralement, une variation de la température
du gaz. |
L’état du système gaz a changé.
L’opérateur a effectué un travail qui, suivant ce que
nous a appris la Mécanique, est un échange d’énergie
entre le système gaz et l’opérateur extérieur. Cet
échange d’énergie se traduit par une modification des variables
d’état.
par transferts thermiques (on dit aussi échange de chaleur
ou échange d’énergie calorifique)
Lorsque nous mettons en " contact " des corps de températures
différentes, nous produisons une modification de l’état
de ces corps (changement des températures et/ou de phases).
L’eau contenue dans une casserole en contact avec la flamme d’un gaz
en combustion voit sa température s’élever puis elle se met
à bouillir c’est à dire elle se transforme en vapeur (gaz).
Nous ne pouvons attribuer ces modifications de l’état du système
à des échanges d’énergie sous forme de travail.
Dans ce cas, nous parlons de transferts thermiques (ou de chaleur).
Cependant, il ne faudrait pas croire que ces deux façons d’agir
sur un système peuvent être totalement équivalentes
: par transferts thermiques, nous ne pouvons jamais affecter directement
le mouvement d’un système.
2.2. Principe d’équivalence
Nous sommes tout à fait capables d’élever la température
de l’eau contenue dans une casserole en mettant en mouvement des palettes
solides (agitateur). Nous produisons des effets tout à fait comparables
à ceux produits par transferts thermiques mais cette fois par échange
d’énergie sous forme de travail.
Est-ce que les transferts thermiques (la chaleur) sont une autre façon
d’échanger de l’énergie entre différents systèmes
?
La question a été longtemps débattue au 19ème
siècle. La réponse fait partie du Principe d’équivalence
à savoir que travail de forces et chaleur sont les deux seules
façons possibles d’échanger de l’énergie entre systèmes
fermés.
Les travaux de J. Joule au siècle dernier ont été
déterminants.
Dans un calorimètre (récipient contenant de l’eau dont
les parois peuvent être parfaitement isolées d’un point de
vue thermique), Joule, dans un premier temps, élevait la température
par échange d’énergie sous forme de travail (W était
fourni au calorimètre et compté positivement), dans un deuxième
temps, il ramenait le calorimètre à son état initial
en le refroidissant par échange de chaleur avec l’extérieur
(la chaleur Q était perdue par le calorimètre et compté
négativement).
Les mesures de Joule, sur ce cas expérimental, montrèrent que 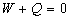
Ce résultat suppose que travail et chaleur soient comptés
dans une même unité.
En fait, avant Joule, les quantités de chaleur étaient
comptées en calories, la calorie étant la quantité
de chaleur nécessaire pour élever 1g d’eau de 14,5
à 15,5 °C sous la pression atmosphérique normale.
Les expériences de Joule établissent un rapport entre
l’unité travail (appelé actuellement Joule) et l’unité
chaleur compris entre 4,1855 et 4,1860.
1 cal = 4,18 joules
Le résultat 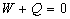 généralisé à tout système constitue le principe
d’équivalence que nous énoncerons ainsi :
généralisé à tout système constitue le principe
d’équivalence que nous énoncerons ainsi :
" Dans une expérience dans laquelle rien n’a varié d’autre
que des quantités de travail et de chaleur échangées
avec l’extérieur, il y a équivalence entre le travail et
la chaleur "
ou
" Lorsqu’un système thermodynamique fermé quelconque
subit un cycle de transformations qui le ramène à son état
initial, la somme du travail W et de la chaleur Q échangés
est nulle "
2.3. Energie interne
Nécessité de l’énergie interne
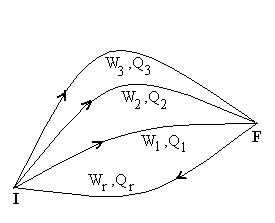 |
Soit un système fermé évoluant
d’un état I à un état F en échangeant avec
l’extérieur du travail W et de la chaleur Q, sans
que son énergie mécanique change. Imaginons plusieurs transformations
notées 1, 2, ... pour aller de l’état I à l’état
F et une transformation r ramenant de l’état F à l’état
I. Nous appliquons le principe d’équivalence pour les différents
cycles, à savoir :
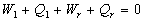
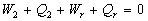
....
 |
La quantité W + Q est indépendante de la
transformation amenant de l’état I à l’état F. Elle
ne dépend donc que des états I et F dont on rend compte par
les variables d’état.
Par définition, la somme W + Q est la variation
de l’énergie interne U du système.
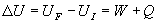
Définie par une variation, l’énergie interne U
n’est connue qu’à une constante additive près. Elle ne dépend
que de l’état du système.
Pour un système en état d’équilibre où
les variables d’état (c’est à dire les paramètres
mesurables qui rendent compte de l’état du système) sont
constantes et uniformes, l’énergie interne est une fonction de celles-ci.
Par définition, on appelle fonction d’état une
fonction des variables d’état.
Aussi l’énergie interne U est une fonction d’état 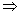 U = U(variables d’état)
U = U(variables d’état)
Visualisation de l’énergie interne
Compte tenu de ce que nous savons sur la structure de la matière,
de l’énergie cinétique qui ne fait appel qu’à l’aspect
macroscopique du système et de l’énergie potentielle qui
est le résultat d’interactions avec d’autres systèmes macroscopiques,
l’énergie interne est une notion simple qui comprend
:
- l’énergie cinétique " microscopique " des particules
constituant le système dans un référentiel où
les particules sont globalement au repos,
- l’énergie des interactions entre particules,
- l’énergie de liaison des molécules (énergie
chimique),
- l’énergie de liaison des constituants de l’atome (énergie
atomique ou nucléaire).
Une propriété importante de l’énergie interne découle
de ce propos : l’énergie interne a un caractère additif.
2.4. Premier Principe de la Thermodynamique pour
un système fermé
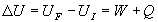
-
U énergie interne est une fonction d’état ; sa variation
est indépendante de la transformation et ne dépend que des
états initial et final.
-
L’énergie interne a un caractère additif.
-
Le terme W représente le travail de forces produites par
un opérateur extérieur qui affectent l’état thermodynamique
(variables d’état) du système et Q représente
la chaleur. Ce sont les deux façons, pour un système fermé
isolé mécaniquement, d’échanger de l’énergie
avec d’autres systèmes appelés milieu extérieur.
-
Puisqu’il s’agit d’échanges, il serait fondamentalement faux
d’attribuer
travail et/ou chaleur à un système particulier.
-
W et Q dépendent de la transformation qui amène
d’un état initial à un état final.
-
En cohérence avec la Mécanique, ils sont comptés positivement
pour un système s’ils sont reçus par celui-ci, négativement
s’ils sont perdus (ou fournis) par le système.
-
Evidemment, la relation n’est plus valide si le système subit des
variations d’énergie mécanique " macroscopique ".
Pour une transformation quasi-statique, entre deux états d’équilibre
infiniment proches, le premier principe s’écrit :
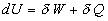 où dU
est une différentielle totale exacte.
où dU
est une différentielle totale exacte.
 sont des formes
différentielles qui ne sont pas des différentielles totales exactes.
Les fonctions W et Q n’existent pas.
sont des formes
différentielles qui ne sont pas des différentielles totales exactes.
Les fonctions W et Q n’existent pas.
3. Mécanique et Thermodynamique.
Principe de conservation de l’énergie
Nous avions conclu le paragraphe 1 de ce chapitre sur un certain nombre
de questions pour lesquelles nous sommes, en mesure, de répondre.
En Mécanique et en Thermodynamique, nous avons exprimé
que, lorsqu’un système reçoit ou perd de l’énergie
(mécanique ou interne), un autre système a fourni ou a reçu
cette énergie.
En Mécanique, dans le cas des forces de frottement, on note
qu’il y a perte systématique d’énergie mécanique c’est
à dire que le travail des forces de frottement est négatif.
Qu’est devenue cette énergie mécanique perdue ?
Remarquons,
- d’une part, que l’énergie totale d’un système est égale
à 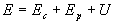 ,
,
- d’autre part, que des forces de frottement naissent parce qu’un milieu
s’oppose au déplacement d’un corps ; les forces de frottement ne
créent pas le mouvement, elles naissent de l’action d’une force
extérieure qui provoque un déplacement.
Choisissons comme système l’ensemble corps en " mouvement
libre " et milieu résistant (la notion de mouvement est toujours
relative).
Suivant ce nous appellerons le " Principe de conservation de l’énergie
", la perte d’énergie mécanique produit une augmentation
égale de l’énergie interne du système s’il est isolé
: l’énergie totale du système est conservée.
Le fait que les températures dans le système augmentent confirme
nos propos mais S’il n’est pas isolé, il se produira des échanges
d’énergie (souvent sous forme de chaleur) avec le milieux extérieur
qui seront égales à une partie (le complément se fera
en augmentation d’énergie interne du système) ou à
toute la perte d’énergie mécanique (dans ce cas, les températures
restent constantes).
Remarques :
- en Thermodynamique, les forces de frottement doivent être comprises
comme des forces internes,
- nous ne pouvons définir le partage du gain d’énergie
interne entre corps en mouvement et milieu résistant (pour cela,
il nous faut des connaissances supplémentaires sur le frottement),
- le travail des forces de frottement (perte d’énergie mécanique)
ne devient pas obligatoirement de la chaleur (nous voyons
ceci trop souvent écrit, sous-entendu comme allant de soi ou dit,
pour ne pas attirer fortement l’attention du lecteur).
Principe de conservation de l’énergie.
Pour un système dont l’énergie mécanique et l’énergie
interne peuvent varier, nous postulons la conservation de l’énergie,
à savoir,
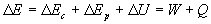
Ainsi toute augmentation (ou diminution) d’énergie d’un système
s’accompagne d’une diminution égale (ou augmentation égale)
de l’énergie d’autres systèmes.
La création spontanée d’énergie
n’existe pas.
Dans notre monde moderne, nous consommons énormément d’énergie
interne dans les réactions chimiques (combustion) ou nucléaires.
Nous transformons cette énergie dans les moteurs thermiques en énergie
mécanique. Nous utilisons cette énergie sous cette forme
ou, après transformation, sous forme d’énergie électrique.
Une fois utilisée, nous avons une augmentation de l’énergie
mécanique microscopique de notre environnement ... inutilisable.
Premier principe de la Thermodynamique pour un système ouvert
La matière contient de l’énergie, il y a donc une autre
possibilité d’échanger de l’énergie : échanger
de la matière. Notre écriture du principe de conservation
de l’énergie n’est donc pas étendue au cas de l’échange
de matière.
Le transfert d’énergie accompagnant l’échange de matière
est abordé dans le paragraphe " Notions simples sur les systèmes
ouverts " du chapitre "Considérations sur les machines thermiques".
Nous aurons besoin toute de suite de la fonction d’état enthalpie 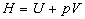 ,son
sens physique sera donné lors du paragraphe cité.
,son
sens physique sera donné lors du paragraphe cité.

