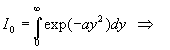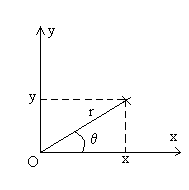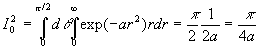Description microscopique de la matière
Plan
1. Introduction : gaz, liquide, solide
2. Les particules de base de la matière
2.1. L'hypothèse atomique
2.2. La particule de base
3. Les deux états de la matière : l'état
désordonné et l'état ordonné
3.1. L'état désordonné
3.2. L'état ordonné
Annexe : la loi de distribution des vitesses de Maxwell
Physiciens et chimistes étudient les propriétés
de la matière. Leurs domaines respectifs ne sont pas réservés,
ils appartiennent à un même domaine scientifique appelé
Sciences
Physiques. Les collègues de l’enseignement secondaire sont professeurs
de Physique et Chimie. Parce que le domaine de connaissances en Sciences
Physiques croît de manière exponentielle, l’enseignement supérieur
a été amené à distinguer des professeurs de
Physique et des professeurs de Chimie sans qu’il y ait une frontière
réelle, tangible entre eux.
Traditionnellement, les premières notions d’atomistique,
de liaisons et d’édifices entre les atomes font partie des leçons
de Chimie de l’enseignement secondaire.
Nous ne croyons pas que l’on puisse faire des études de Physique
en ignorant ces pré-requis.
1. Introduction : gaz, liquide, solide
Communément, on classe les milieux matériels en solides
et fluides.
Ces deux notions, comme beaucoup de notions premières, ne sont
pas simples à définir, la difficulté augmente si l'on
souhaite, comme tout un chacun, distinguer les liquides et les gaz à
l'intérieur de la famille fluide.
Remarquons cependant que tout au long du premier chapitre nous avons
utilisé notre sens commun pour nous représenter la matière
et avons pu, sans trop de difficulté de compréhension entre
nous, donner un contenu scientifique à des notions aussi tangibles
que pression ou température.
Il n’est jamais inutile d’ouvrir un dictionnaire et de chercher le sens
qui peut être donné aux mots.
Ouvrons (sans en faire publicité) le "Petit Robert" et regardons
les définitions à usage courant.
Fluide : "Qui n'est ni solide, ni épais, coule aisément".
Mais l'huile, par exemple, c'est épais ou non ? Allons voir à
solide.
Solide : "Qui a de la consistance, qui n'est pas liquide, tout
en pouvant être plus ou moins mou". Qui n'est pas liquide ? Allons
voir à liquide.
Liquide : "Tout corps qui coule ou tend à couler". Peut-on
dire que le sable sec qui coule entre les doigts est un liquide?
Les définitions à usage courant semblent bien floues,
aussi dans le même dictionnaire nous considérons les définitions
scientifiques.
Fluide : "Tout corps qui se laisse déformer sous l'action
de forces minimes; tout corps qui épouse la forme de son contenant"
Solide : "Se dit d'un corps dans lequel les molécules
sont très rapprochées les unes des autres et vibrent avec
une très faible amplitude autour de leur position d'équilibre;
qui a de la cohésion, garde une forme relativement constante lorsqu'il
n'est pas soumis à des forces extérieures"
Liquide : "Tout corps à l'état fluide, pratiquement
incompressible, formé de corpuscules (ions ou molécules)
soumis à de faibles attractions"
Gaz : "Tout corps qui se présente à l'état
de fluide expansible et compressible (état gazeux) dans les conditions
de température et de pression normales"
Cette lecture permet de dégager quelques pistes :
-
celles liées à la forme : un solide a une forme propre,
certes susceptible de changer mais on le reconnaît ; un fluide, quant
à lui, n’a pas de forme propre et prend la forme du récipient
qui le contient
-
celles liées aux forces à exercer pour déformer
le milieu : pour les fluides elles sont faibles devant celles nécessaires
à la déformation d'un solide ; en particulier un fluide ne
peut rester insensible à une "caresse"
-
celles liées à la compressibilité : les liquides
sont, en première approximation, incompressibles ce qui n’est pas
le cas des gaz ; toutefois les liquides sont plus compressibles que les
solides.
Sans doute, avons nous l’impression d’en savoir plus, mais pour progresser
on devra " prendre un microscope " c'est à dire faire intervenir
une conception microscopique de la matière.
2. Les particules de base de la matière
2.1. L’hypothèse atomique (ou moléculaire)
L’hypothèse est banale (universellement admise). Elle était
déjà émise par les philosophes de la Grèce
antique. Par contre les premières preuves expérimentales
- Dalton, Proust, Lavoisier au 19ème
siècle - sont relativement récentes.
Si, dans un cataclysme, toute notre connaissance scientifique devait
être détruite et qu’une seule phrase passe aux générations
futures, quelle affirmation contiendrait le maximum d’information dans
le minimum de mots ? N’est ce pas l’hypothèse atomique à
savoir " toutes les choses sont faites d’atomes (de molécules),
petites particules en agitation incessante, s’attirant mutuellement à
petite distance les unes des autres et se repoussant si on cherche à
trop les rapprocher ". Dans cette seule phrase vous verrez qu’il y a une
énorme quantité d’informations sur le monde, si on lui applique
un petit peu d’imagination et de réflexion. The Feynman Lectures
on Physics par Richard P. Feynman, Robert B. Leighton et Mattews Sands.
Sans doute, cette phrase de Richard P. Feynman, prix Nobel de Physique
en 1965, est suffisante pour aborder un premier cours de Thermodynamique
à condition de la compléter par :
- un modèle pour l’atome à savoir il est identifiable
à une " masse ponctuelle " assimilable à une " sphère
rigide, très petite ",
- un modèle pour la molécule qui est constituée
d’atomes en très forte interaction entre eux c’est à dire
à distances pratiquement constantes les uns des autres, soit encore
vibrant avec des amplitudes très faibles autour de leur positions
d’équilibre respectives.
Cette phrase est très insuffisante pour comprendre le comportement
de la matière soumise à un champ électrique et/ou
magnétique, pour aborder l’interaction onde-matière c’est
à dire une physique dite " moderne " celle qui ne s’est construite
qu’à partir du début du 20ème siècle.
La compressibilité des gaz, la presque incompressibilité
des liquides et des solides permet de dire que les atomes d’un liquide
ou d’un solide sont " entassés " les uns sur les autres alors que
ceux d’un gaz sont éloignés les uns des autres. Ceci est
confirmé par la masse volumique qui est faible (peu d’atomes par
unité de volume) pour les gaz et importante pour les liquides et
les solides, par le fait que nous nous sentons " léger " (forte
poussée d’Archimède) dans l’eau et " lourd " dans l’air,
que nous avons du mal à marcher dans l’eau, …
L’état gazeux est un état dilué alors
que liquides et solides font partie des états condensés.
2.2. La particule de base
2.2.1. L'atome
Toute matière est constituée d'atomes.
L'atome est constitué d'un noyau comportant Z protons et d'un
nombre au moins égal de neutrons (à l'exception de l'atome
d'hydrogène qui ne comporte pas de neutron), de Z électrons
gravitant autour du noyau.
En Chimie, on apprend qu’il existe une bonne centaine d’atomes " libres
". Le tableau de Mendeleïev les regroupe de manière ordonnée
suivant leurs caractéristiques. Les théories quantiques actuellement
admises ont considérablement perfectionné ce modèle
atomique élémentaire rappelé ici.
La masse du proton est égale à 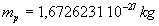 et sa charge
et sa charge 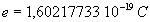 .
.
La masse du neutron est égale à 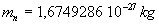 ,
il est électriquement neutre.
,
il est électriquement neutre.
La masse de l'électron est égale à 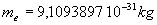 et sa charge est égale et opposée à celle du proton.
et sa charge est égale et opposée à celle du proton.
Chacun des Z électrons est dans un " état " caractérisé,
entre autres, par l'énergie qu'il faut dépenser pour le libérer
sans vitesse appréciable de l'atome. Les valeurs de ces énergies
permettent de classer les Z électrons en " couches " de même
énergie où le nombre possible d'électrons est
limité. Les niveaux d’énergie entre couches sont nettement
séparées au moins pour les plus fortes valeurs.
On distingue ces couches en introduisant un nombre entier positif n appelé
nombre quantique principal. Ainsi, la couche la plus profonde (première
à partir du noyau) appelée K correspond à 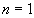 ,
la seconde L à
,
la seconde L à 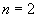 et ainsi de suite.
et ainsi de suite.
Pour l’atome d’hydrogène (et pour les ions hydrogénoïdes
qui, comme l’atome d’hydrogène ne possèdent qu’un électron),
l’énergie de l’électron suivant la couche où il se trouve
est égale à :  .
.
Pour des atomes ou des ions polyélectroniques, les règles
de Slater pour calculer l’énergie d’un électron d’une couche
constituent une bonne approximation empirique.
Pour 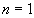 , la formule
ci-dessus reste valide ; pour l'Uranium (
, la formule
ci-dessus reste valide ; pour l'Uranium (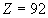 ),
les mesures donnent 115600 eV.
),
les mesures donnent 115600 eV.
Les électrons d’une couche " tournent " sur des orbites définies
par les nombres quantiques secondaire et magnétique.
-
le nombre quantique secondaire quantifie le moment cinétique de
l’électron sur son orbite
(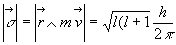 où l prend
toute valeur entière telle que
où l prend
toute valeur entière telle que 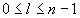 ; h : Constante de Planck
; h : Constante de Planck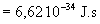 )
)
- le nombre quantique magnétique quantifie la projection du moment
cinétique suivant la direction d’un champ magnétique extérieur
imposé (
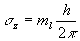 où
où  prend toute valeur entière telle que
prend toute valeur entière telle que 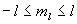 ).
).
Le nombre d’orbitales atomiques (ou orbites possibles pour l’électron)
pour une couche de nombre quantique principal n est égal à 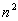 nombre de combinaisons différentes entre les valeurs des nombres quantiques
secondaire et magnétique.
nombre de combinaisons différentes entre les valeurs des nombres quantiques
secondaire et magnétique.
L’interprétation de l’expérience de Stern et Gerlach montre qu’il
convient d’introduire un moment cinétique propre au mouvement de l’électron
sur lui-même. A ce moment cinétique, est associé un moment
cinétique de spin dont la projection suivant la direction du champ
magnétique imposé est égal à 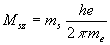 où
où 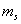 est
le nombre quantique magnétique de spin. Ce nombre ne peut prendre
que les deux valeurs
est
le nombre quantique magnétique de spin. Ce nombre ne peut prendre
que les deux valeurs 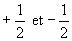 .
.
Suivant le principe de Pauli, deux électrons d’un atome
ne peuvent avoir leurs quatre nombres quantiques identiques.
2.2.2. Les particules de base
Etablir un modèle de structure de la matière consiste
à décrire l'arrangement des atomes, en représentant
leurs positions respectives et la répartition des différentes
espèces. Ce qu'on pourrait imaginer de plus simple serait que les
atomes se comportent comme des constituants, doués de propriétés
spécifiques, parfaitement définis et immuables. Ce n’est
pas aussi simple puisque les atomes apparaissent dans la matière
avec des petites différences par rapport au schéma de l'atome
libre qui fait l'objet du tableau de Mendeleïev. Ces petites différences
sont essentielles pour rendre compte des propriétés de la
matière.
En fait, dans une transformation physique ou une réaction chimique,
seul l'état des quelques électrons externes peut être
modifié. La ménagère sur sa cuisinière, le
chimiste dans son laboratoire, le métallurgiste avec son haut-fourneau
ou son four à arc ne peut qu'égratigner les atomes. Avec
une excellente approximation, le noyau et tous les électrons
sauf les quelques uns des couches externes sont immuables.
Toute matière est faite d'un ensemble " d'entités ",
comme une construction est faite de briques, différentes suivant
la matière. Nous désignons ces entités par le terme
"
particule " ou mieux " particule de base ". Dans quelques cas
rares ce sont des atomes tels qu'ils sont à l'état libre,
plus souvent des atomes modifiés par l'altération des couches
électroniques externes ou des groupes d'atomes définis appelés
" molécules ".
La " particule de base " est représentée par un objet
de forme et de dimensions déterminées et le modèle
de la matière est l'assemblage de ces objets. Ainsi un atome est
représenté par une sphère de diamètre donné
et un ensemble d'atomes par de telles sphères pressées les
unes contre les autres. A priori cette représentation n'est pas
évidente mais elle apporte une image simplificatrice primordiale
pour notre compréhension de la structure de la matière.
La molécule mono et polyatomique
Les gaz rares sont caractérisés par une couche électronique
externe complète (qui ne peut accepter un électron de plus).
Cette propriété les fait bénéficier d'une stabilité
toute particulière qui les rend pratiquement inerte et la particule
de base est faite d'un atome non altéré. On parle de molécules
monoatomiques.
Les atomes, autres que les gaz rares, se lient entre eux suivant des
schémas bien définis formant un ensemble stable appelé
molécule
polyatomique. La liaison interatomique provoque l'altération
de l'état des électrons des couches externes. Décrire
les modes de liaisons et les mécanismes des " réactions "
relève du domaine de la Chimie, le minimum à connaître
étant les règles de " remplissage ".
Dans la matière à l'état dilué (gaz),
la molécule (à l’exception des plasma qui sont constitués
d’ions et d’électrons) est la particule de base.
Dans celle à l'état condensé (liquide et
solide),
- pour ce qui concerne les liquides (à l’exception des
liquides ioniques et des cristaux liquides), la particule de base est la
molécule,
- pour ce qui concerne les solides (à l’exception des
solides amorphes et des solides moléculaires) la particule de base
est soit l’atome, soit l’ion.
Les atomes, éléments de la matière condensée
Ce sont bien des atomes mais ils n'ont pas exactement la même
constitution que l'atome de même espèce à l'état
isolé. En effet, quand la matière est condensée, cela
signifie que chaque atome se trouve au contact d'autres, donc qu'il est
soumis à des interactions qui altèrent l'état des
électrons de la couche superficielle.
C'est ce qui se passe pour les atomes formant les molécules,
la différence essentielle est que, dans la molécule, les
atomes constituants forment un système fini, bien défini,
auquel on ne peut adjoindre ou retirer un atome sans modifier profondément
la molécule. Au contraire, dans un solide dont les éléments
constitutifs sont des atomes, ceux-ci forment des chaînes en interaction
non finies.
Nous illustrons notre propos avec l'atome de Carbone qui possède
6 électrons, 2 sur sa première couche (K) qui est complète
et quatre sur sa deuxième couche (L) externe qui peut être
complétée à 8.
Avec 4 atomes d'Hydrogène, le Carbone forme la molécule 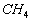 ,
ensemble fini, où le Carbone partage les 4 électrons des atomes
d'Hydrogène pour compléter sa couche externe, où chaque
atome d'Hydrogène partage 1 électron de l'atome de Carbone pour
compléter sa seule couche à 2 électrons.
,
ensemble fini, où le Carbone partage les 4 électrons des atomes
d'Hydrogène pour compléter sa couche externe, où chaque
atome d'Hydrogène partage 1 électron de l'atome de Carbone pour
compléter sa seule couche à 2 électrons.
Dans le solide diamant, un atome de Carbone partage 1 électron
avec chacun des 4 atomes de Carbone qui l'entourent pour compléter
sa couche externe, ces derniers en faisant de même si bien que les
atomes du diamant forment des chaînes bien déterminées
qui se développent dans toutes les directions. Il n'y a pas de molécule
de diamant. En ce qui concerne les atomes de Carbone à la surface
du diamant, ils complètent leur couche externe avec des impuretés
de l'atmosphère environnante pour assurer la stabilité de
l'édifice diamant.
Les ions, éléments de la matière condensée
Un atome, dont le nombre atomique est supérieur de quelques unités
(1, 2, 3, voire 4) à celui d'un gaz rare, retrouve la configuration
électronique de celui-ci s'il perd ses électrons extérieurs.
Cette opération, qui nécessite peu d'énergie,
explique l’existence des solides et liquides métalliques . L'atome
n'est plus électriquement neutre : il devient un ion chargé
positivement -cation- de 1, 2, ... charges élémentaires,
environné d’un nombre égal d’électrons " libres ".
L’existence de charges positives et négatives, qui s’attirent, donnent
une cohésion à l’assemblage.
Inversement, si l'atome à 1, 2, ... électrons de moins
qu'un gaz rare, des électrons libres (à énergie nulle)
peuvent venir occuper des places vacantes de la couche externe de niveau
d'énergie inférieure. L'atome devient un ion chargé
négativement -anion-.
La formation d’ions de nature opposée est spontanée si
le bilan énergétique est exothermique.
| Exemple : |
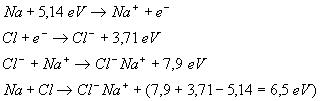 |
Il convient de bien comprendre.
A l’état gazeux il existe une molécule (dans l’exemple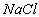 ).
Pour ce qui est de l’état solide ou liquide, il s’agit d’un ensemble
d'ions positifs et négatifs (dans l’exemple
).
Pour ce qui est de l’état solide ou liquide, il s’agit d’un ensemble
d'ions positifs et négatifs (dans l’exemple  )
qui, en s’attirant, assurent la cohésion de l’édifice. Dans cet
ensemble, il n'y a pas de couples isolés (
)
qui, en s’attirant, assurent la cohésion de l’édifice. Dans cet
ensemble, il n'y a pas de couples isolés (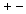 ),
donc pas de molécule : la particule de base du modèle est bien
l'ion, c'est à dire un atome modifié dans sa couche extérieure
par la perte ou le gain d'un petit nombre d'électrons.
),
donc pas de molécule : la particule de base du modèle est bien
l'ion, c'est à dire un atome modifié dans sa couche extérieure
par la perte ou le gain d'un petit nombre d'électrons.
Nos exemples définissent l'ion à partir d'un atome. Il existe
des ions plus complexes constitués de plusieurs atomes liés entre
eux comme dans une molécule, la charge des électrons et des noyaux
ne se compensant pas totalement.
La dimension des ions, atomes et molécules
La masse des particules ne pose pas de problème particulier.
Dans l'atome, toute la masse est pratiquement concentrée dans le
noyau à environ 1/4000 près ou moins. La modification de
l'état des électrons, et de légers changements dans
leur nombre, ne font pas varier la masse qui est simplement celle du ou
des noyaux constituant la particule.
Les dimensions géométriques sont plus délicates à
définir. Dans l'image qu'en donne la mécanique quantique, l'atome
libre est constitué par un nuage d'électricité négative,
de charge totale  ,
autour du noyau ponctuel de charge
,
autour du noyau ponctuel de charge  .
La densité locale de charge est calculable par les équations de
la mécanique quantique.
.
La densité locale de charge est calculable par les équations de
la mécanique quantique.
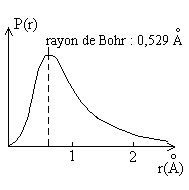 |
Pour l'atome d'Hydrogène qui peut être calculé rigoureusement,
la figure ci-contre donne la probabilité de présence de l'électron
à une distance r.
Elle est maximale pour la valeur du rayon de Bohr, égale à
50% pour r = 0,707 Å, à 90% pour r = 1,408 Å. |
La situation est très différente dans les ensembles denses
d'atomes qu'on observe dans la matière condensée, solide
ou liquide.
- Le cas le plus simple est celui des ions où il est possible, expérimentalement,
de mesurer la distance entre deux ions
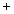 et
et  immédiatement voisins. L'ensemble des mesures sur un grand nombre de
cristaux ioniques conduit à la règle fondamentale suivante :
chaque espèce d'ions peut, avec une bonne approximation, être
assimilé à une " sphère dure ", c'est à dire indéformable,
de rayon déterminé; la distance entre les centres de deux ions
voisins est égale à la somme des rayons attribués à
chacun des ions, tout comme s'il s'agissait de deux sphères indéformables
tangentes.
immédiatement voisins. L'ensemble des mesures sur un grand nombre de
cristaux ioniques conduit à la règle fondamentale suivante :
chaque espèce d'ions peut, avec une bonne approximation, être
assimilé à une " sphère dure ", c'est à dire indéformable,
de rayon déterminé; la distance entre les centres de deux ions
voisins est égale à la somme des rayons attribués à
chacun des ions, tout comme s'il s'agissait de deux sphères indéformables
tangentes.
On montre que le rayon des ions homologues croit relativement peu avec
Z, beaucoup moins que la masse atomique ce qui est logique si on considère
qu’une charge de noyau croissante tend à rapprocher les électrons
du centre mais que ceux-ci, plus nombreux, tendent à occuper un
espace plus grand.
Dans les métaux, la particule de base est un ion positif, l'atome
ayant perdu 1, 2 ou 3 électrons devenus libres et qui forment une
" mer d'électricité " négative. La règle énoncée
pour le calcul des rayons restent vraie mais on trouve des rayons d'atomes
métalliques plus grands, quelque fois beaucoup plus grands, que
les rayons d'atomes ioniques de même espèce. On explique cela
en remarquant que les ions d'un métal se repoussent et que c'est
la " mer " d'électrons qui les maintient à la distance où
ils se trouvent. Le fait qui peut paraître étrange, c'est
que, bien qu'un métal soit en réalité assez vide,
ses ions se comportent comme des sphères dures au contact.
-
Le cas des ensembles où la particule de base est la molécule
(liquide) ou l'atome (solide cristallin) est beaucoup plus complexe.
Pour l'ion, la couche externe est devenue très stable et reste
semblable quel que soit l'ion au contact. Ce n'est plus le cas et la liaison
affecte la couche externe.
Ce qui est déterminé de façon précise à partir
des mesures sur les cristaux, c'est la distance entre les centres d'un couple
d'atomes voisins d'espèces données et liés par une liaison
de type donné. Ainsi par exemple, la distance 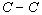 est de 1,54 Å, celle
est de 1,54 Å, celle 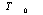 est de 1,34 Å, celle
est de 1,34 Å, celle 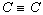 est de 1,20 Å. Par contre, si l'atome a comme voisin un atome d'une autre
molécule auquel il n'est donc pas lié, il pourra s'en approcher
jusqu'à une distance appelée rayon de Van der Waals (pour le Carbone
1,80 Å). A l'intérieur d'une molécule les sphères
de Van der Waals des différents atomes s'interpénètrent
puisque les atomes d'une même molécule sont liés.
est de 1,20 Å. Par contre, si l'atome a comme voisin un atome d'une autre
molécule auquel il n'est donc pas lié, il pourra s'en approcher
jusqu'à une distance appelée rayon de Van der Waals (pour le Carbone
1,80 Å). A l'intérieur d'une molécule les sphères
de Van der Waals des différents atomes s'interpénètrent
puisque les atomes d'une même molécule sont liés.
On accède, dans la matière condensée, au type
d'empilement des molécules par la forme extérieure de la
matière.
Remarque
Ce que nous venons d'expliquer est très simplifié.
En particulier, rien ne nous permet de comprendre ce qui empêche
deux atomes en interaction de se pénétrer jusqu'aux noyaux
puisqu'ils sont essentiellement constitués de vide. Il faut, pour
cela, abandonner les concepts classiques pour la mécanique quantique
et introduire les interactions nucléaires.
3. Les deux états de la matière
: l'état désordonné et l'état ordonné
Le sens commun nous fait distinguer trois états de la matière
: solide, liquide et gazeux ... sans que nous soyons capables d'en faire
les distinguo de manière rigoureuse.
Le modèle atomique de la matière conduit à une
séparation des états physiques en deux classes dont le mérite
est une coupure plus franche : le première classe est dite à
structure
désordonnée, la deuxième à
structure
ordonnée.
3.1. L'état désordonné : du
gaz au liquide
3.1.1. Agitation au niveau microscopique
Les modèles ne sont jamais statiques (ce qui n'est pas en contradiction
avec " statique " ou " globalement au repos " au niveau macroscopique).
C'est particulièrement évident pour un gaz où
la matière est diluée c’est à dire où les particules
sont " libres " de leur déplacement. En effet, si elles n'étaient
pas en mouvement, du fait du champ de pesanteur, elles ne pourraient être
qu'entassées à partir du fond du récipient qui les
contient ou à partir du sol ce qui ne peut manifestement être
le cas pour une substance diluée.
Ainsi dans les gaz, s’introduit la notion de mouvement sans cesse des
particules, dans toutes les directions au gré des chocs, que l'on
appelle agitation. Les particules seront attirées vers les
altitudes les plus faibles mais sans pouvoir s'y entasser.
Dans un gaz, les interactions entre particules sont faibles (matière
diluée, particules en moyenne éloignées les unes des
autres), les mouvements de celles-ci sont assez libres, il règne
un désordre, que l'on qualifie de parfait si on néglige
toute interaction entre particules.
La Théorie cinétique des gaz lie agitation
et température, c'est pourquoi on parle d'agitation thermique.
3.1.2. Interprétation microscopique de la pression
Une conséquence de l'agitation est une visualisation locale (au
niveau microscopique) de la pression.
La pression est la force moyenne par unité de surface due aux
particules venant frapper une paroi.
La pression augmente :
- avec le nombre de chocs contre la paroi donc, dans une enceinte de
volume V, avec le nombre N de particules (soit, en fait, avec N/V),
- avec l'agitation des particules puisque la quantité de mouvement
transférée de la particule à la paroi sera d'autant
plus importante.
Notons l'accord entre le caractère non directionnel de la pression
et le fait que le mouvement des particules ait lieu dans toutes les directions.
De même pour que la pression tende vers une valeur nulle (comportement
limite de tous les gaz réels appelé gaz parfait), il convient
que le nombre de chocs soient faible, c’est à dire que la densité
des particules soit faible, c’est à dire qu’en moyenne elles soient
éloignées les unes des autres, donc que les interactions
entre les particules soient négligeables.
3.1.3. Facteur de Boltzmann. Raréfaction de l'air
Nous traitons là un exemple de statique des fluides compressibles,
l’air atmosphérique obéissant à l’équation d’état
des gaz parfaits.
Nous cherchons à savoir comment varie la pression p avec l’altitude
z. Nous formulons l’hypothèse justifiée que l’air
est un mélange idéal de gaz parfaits et celle fausse dans la
troposphère (altitude comprise entre 0 et 20 km) que
la température est la même quelque soit l’altitude.
Soient 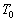 la température
et
la température
et 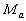 la masse
molaire de l’air.
la masse
molaire de l’air.
Nous utilisons le principe de l’hydrostatique dp = -mg
dz et l’équation d’état des gaz parfaits.
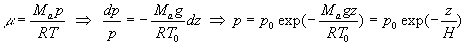

A température uniforme, la pression est proportionnelle à la masse
volumique ainsi qu’à la densité volumique molaire.
On obtient : 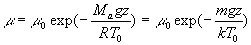
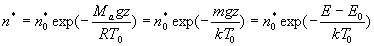
où m = Ma /N
représente la masse " moyenne " d’une molécule d’air.
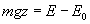 est l’énergie
potentielle dans le champ de pesanteur terrestre de la " molécule d’air
" à l’altitude z.
est l’énergie
potentielle dans le champ de pesanteur terrestre de la " molécule d’air
" à l’altitude z.
Cette application nous explique le phénomène de raréfaction
de l’air avec l’altitude, à savoir la densité moléculaire
diminue avec l’altitude suivant une fonction dépendant de l’énergie
de la molécule à cette altitude et de la température.
La fonction 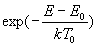 appelée facteur de Boltzmann est d’une importance considérable
en Physique statistique.
appelée facteur de Boltzmann est d’une importance considérable
en Physique statistique.
Dans l'exemple considéré, elle s’interprète de la manière
suivante : le rapport  est la probabilité de présence d'une molécule à
l'altitude z. Si, pour une altitude, ce rapport est égal à 1/2,
ceci veut dire qu'il y a deux fois moins de molécules à cette
altitude qu'à l'altitude de référence ou, exprimé
différemment, que la probabilité de présence d'une molécule
à l'altitude z est 50% de celle de la trouver à l'altitude de
référence.
est la probabilité de présence d'une molécule à
l'altitude z. Si, pour une altitude, ce rapport est égal à 1/2,
ceci veut dire qu'il y a deux fois moins de molécules à cette
altitude qu'à l'altitude de référence ou, exprimé
différemment, que la probabilité de présence d'une molécule
à l'altitude z est 50% de celle de la trouver à l'altitude de
référence.
3.1.4. Température cinétique. Equipartition de l'énergie.
Energie d’un gaz parfait
La distribution des vitesses des centres de masse des molécules
d’un gaz parfait en équilibre à température T
vérifie
le facteur de Boltzmann.
Ce résultat est connu sous le nom de loi distribution des
vitesses de Maxwell-Boltzmann et entre dans le cadre de la théorie
cinétique du gaz parfait.
Résultat des travaux de Maxwell et de Boltzmann à la
fin du 19ème siècle, elle a été
validée expérimentale par les expériences sur les
" jets monoatomiques ". Il convient de citer la première en 1947
de Estermann, Simpson et Stern et celle très convaincante réalisée
en 1959 par Marcus et McFee.
Pour faciliter la lecture de ce cours, nous avons fait le choix de
reporter en annexe à la fin de ce chapitre la présentation
de " La théorie cinétique du gaz parfait ".
Nous retiendrons deux résultats fondamentaux :
-
 où
où 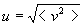 ,
appelé vitesse quadratique moyenne, est la racine de la valeur moyenne
du carré du module de vitesse (l’écriture symbolique < Q
> signifie valeur moyenne de la quantité Q).
,
appelé vitesse quadratique moyenne, est la racine de la valeur moyenne
du carré du module de vitesse (l’écriture symbolique < Q
> signifie valeur moyenne de la quantité Q).
Suivant ce résultat, la température est une mesure de l'agitation
(on parle d'agitation thermique ou de température cinétique).
-
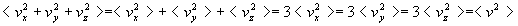 relation qui
traduit qu'en moyenne l'énergie se répartit par quantité
égale à
relation qui
traduit qu'en moyenne l'énergie se répartit par quantité
égale à 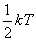 sur chaque possibilité d'énergie indépendante.
sur chaque possibilité d'énergie indépendante.
Ce résultat est général en Physique et constitue
le théorème d'équipartition de l'énergie.
Remarque : en remplaçant dans l’équation d’état du
gaz parfait, on obtient 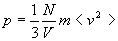 relation tout à fait cohérente avec l’interprétation microscopique
de la pression.
relation tout à fait cohérente avec l’interprétation microscopique
de la pression.
Energie interne d’un gaz parfait
L’énergie interne d’un gaz parfait est constituée des énergies
cinétiques des molécules dans leur mouvement et de la somme (que
nous notons  des énergies internes à chaque molécule. Les énergies
d’interaction entre molécules sont négligeables (état raréfié).
des énergies internes à chaque molécule. Les énergies
d’interaction entre molécules sont négligeables (état raréfié).
Pour un gaz monoatomique de N molécules où l’énergie
cinétique des molécules est l’énergiede translation
du centre de masse, on obtient : 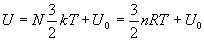 qui correspond à la décomposition d’un mouvement de translation
quelconque en trois mouvements de translation indépendants (ð
3 degrés de liberté).
qui correspond à la décomposition d’un mouvement de translation
quelconque en trois mouvements de translation indépendants (ð
3 degrés de liberté).
En Calorimétrie, on accède par la mesure à la quantité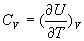 appelé capacité calorifique à volume constant.
appelé capacité calorifique à volume constant.
Le graphique ci-après montre des résultats, pour une
mole de gaz monoatomique raréfié, tout à fait conformes
à la théorie (sauf aux très basses températures).
Pour les gaz polyatomiques raréfiés, les résultats expérimentaux
sont plus complexes : pour les diatomiques, la capacité calorifique molaire
à volume constant  est nulle à 0 K, elle atteint la valeur
est nulle à 0 K, elle atteint la valeur 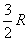 à partir de 2-3 K, puis
à partir de 2-3 K, puis 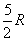 à partir de 150 K,
à partir de 150 K, 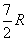 à très hautes températures.
à très hautes températures.
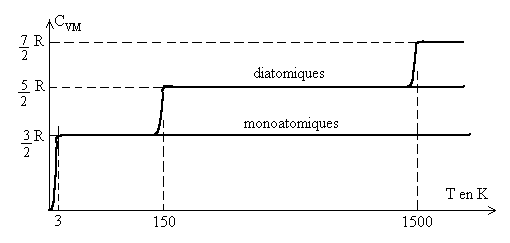
Pour expliquer ces augmentations des valeurs de la capacité calorifique,
il faut ajouter des sources d’énergie : énergie de rotation
des molécules correspondant à deux degrés de liberté
(deux rotations indépendantes) et l’énergie de vibration
des atomes constituant les molécules (deux degrés de liberté
correspondant à de l’énergie cinétique et à
de l’énergie potentielle). On trouve donc une énergie supérieure
à celle trouvée pour un gaz monoatomique.
Pour des molécules d’atomicité supérieure, les
résultats expérimentaux se compliquent mais l’interprétation
en termes d’énergie de translation, de rotation et de vibration
demeure.
Remarque : on ne peut comprendre les évolutions de  avec la température sans notion de mécanique quantique et de quantum
d’énergie.
avec la température sans notion de mécanique quantique et de quantum
d’énergie.
3.1.5. Du gaz comprimé au liquide
Que se passe-t-il quand, sous l'action d'une pression croissante, on
atteint une densité bien plus élevée que celle des
gaz?
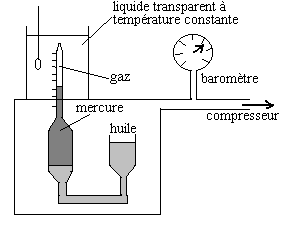 |
Du 17ème siècle jusqu’à
nos jours, de très nombreuses expériences de compressibilité
isotherme des gaz ont été réalisées sur tous
types de gaz, des très basses températures aux très
hautes, jusqu’à des pressions de 1000 atm.
Ci-contre un schéma d’appareillage de compressibilité
isotherme. |
Nous prenons, à titre d'exemple, la matière  contenue
dans un récipient, nous utiliserons le rapport du volume moyen
contenue
dans un récipient, nous utiliserons le rapport du volume moyen 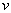 occupé par molécule au volume propre
occupé par molécule au volume propre  de la molécule
de la molécule 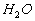 que l'on peut évaluer à 16,8 Å3
.
que l'on peut évaluer à 16,8 Å3
.
Nous partons de l'état gazeux (A) où 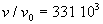 .
C'est typiquement un " gaz " de molécules d'eau.
.
C'est typiquement un " gaz " de molécules d'eau.
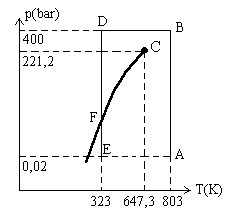 |
Nous comprimons le gaz jusqu'en (B) où 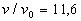 .
La matière est restée parfaitement homogène, aucune
transformation brusque n'est observée. Nous avons, à priori
un gaz comprimé. .
La matière est restée parfaitement homogène, aucune
transformation brusque n'est observée. Nous avons, à priori
un gaz comprimé.
Faisons une autre expérience, nous comprimons à partir de
(E) où 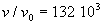 (la
matière est typiquement gazeuse) jusqu'en (D). En (F) où la
pression est de 0,123 bar , il se produit une très forte discontinuité
: quand on diminue le volume offert à la matière, le gaz
se liquéfie ; jusqu'alors homogène, la matière
se divise en deux " phases " de propriétés physiques différentes. (la
matière est typiquement gazeuse) jusqu'en (D). En (F) où la
pression est de 0,123 bar , il se produit une très forte discontinuité
: quand on diminue le volume offert à la matière, le gaz
se liquéfie ; jusqu'alors homogène, la matière
se divise en deux " phases " de propriétés physiques différentes. |
L'une est le gaz qui subsiste, l'autre est une phase dense (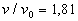 ),
le liquide qui se rassemble à la partie inférieure du récipient
et qui est limitée par une surface libre horizontale au-dessous de la
phase gazeuse. Tant que coexistent les deux phases, la pression ne change pas,
il y a de plus en plus de liquide lorsque le volume diminue.
),
le liquide qui se rassemble à la partie inférieure du récipient
et qui est limitée par une surface libre horizontale au-dessous de la
phase gazeuse. Tant que coexistent les deux phases, la pression ne change pas,
il y a de plus en plus de liquide lorsque le volume diminue.
Quand toute la matière est à l'état liquide, il faut des
augmentations de pression importantes pour obtenir des diminutions de volume
faible. Ainsi en (D), 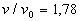 .
.
Revenons à l'état (B) où le gaz est comprimé
et faisons la transformation de (B) à (D). Nous n'observons aucune
discontinuité des propriétés physiques de la matière.
Nous pensons qu'en (D) nous avons un gaz comprimé, alors que l'expérience
précédente nous avait indiqué que c'était un
liquide.
Nous concluons que liquide et gaz sont un même état
désordonné qui se distinguent par la densité.
Le liquide est représentable par un ensemble de molécules
en désordre mais serrées les unes contre les autres, comme
des billes au fond d'un sac. Il existe entre l'état gazeux et l'état
liquide une suite continue d'états intermédiaires avec un
nombre progressivement croissant de molécules par unité de
volume.
Dans la transformation ABD, les molécules de gaz se sont rapprochées
progressivement les unes des autres, la matière restant homogène
à chaque stade de la transformation.
Dans la transformation ED et jusqu'à atteindre l'état
(F), les molécules se rapprochent les unes des autres tout en restant
éloignées, la matière étant homogène.
A partir de ce stade, certaines molécules s'agglutinent (condensation)
formant des îlots de liquide, le reste des molécules non rassemblées
gardent la même densité et produisent la même pression.
Ces îlots fusionnent et grossissent en gouttelettes (dans le champ
de pesanteur, celles-ci tombent), le volume peut diminuer, le gaz conservant
la même pression. Dans la transformation DE, à partir de l'état
(F), les gouttelettes de liquide se désagrègent, en nombre
de plus en plus grand, formant le gaz : ce phénomène est
appelé vaporisation.
Ces explications ne nous permettent pas de comprendre l'existence d'une température
appelée critique (égale à 647,3 K dans l'exemple de l'entité
chimique 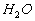 ).
Il faudrait faire appel au mécanisme d'interaction entre les molécules.
).
Il faudrait faire appel au mécanisme d'interaction entre les molécules.
Par contre, ce modèle montre pourquoi un gaz est facilement
compressible alors qu'un liquide l'est très peu.
L'état gazeux à une température inférieure
à la température critique porte le nom spécifique
de vapeur. Lorsqu'il y a coexistence de vapeur et de liquide, la
pression dite pression saturante ne dépend que de la température.
On parle alors de vapeur saturante et de liquide saturant.
On remarquera que le liquide seul a une pression supérieure à
la pression saturante, que la vapeur seule (appelée vapeur sèche)
a une pression inférieure. La vapeur sèche a toutes les caractéristiques
d'un gaz. Il s'agit d'une simple distinction de langage relative au niveau
de température. Vapeur sèche et gaz ont un comportement différent
seulement au cours d'une compression isotherme.
3.1.6. Agitation thermique dans les liquides. Viscosité des
liquides. Solide amorphe
Pour le liquide, comme pour tout autre état de la matière,
un modèle statique au niveau microscopique n'est pas correct car
les molécules de liquide sont soumises à l'inévitable
agitation thermique, par contre les mouvements ne sont pas libres comme
dans un gaz.
Un liquide est un état moins désordonné qu'un
gaz.
Beaucoup de molécules encastrées entre leurs voisines
ne peuvent que vibrer. Il peut arriver qu'une molécule puisse s'échapper
et échanger sa position avec une autre : c'est l'origine du phénomène
de diffusion, facile à mettre en évidence dans le
cas de deux liquides miscibles.
Pour les liquides, il n’y a pas de résultats (ni de théories)
simples
La viscosité des liquides
Quand un liquide n'est pas en équilibre au fond d'un récipient,
il coule. Les molécules glissent les unes sur les autres, elles
sont maintenues en une masse compacte de volume constant par les forces
de cohésion interne qui n'empêchent pas la forme extérieure
du liquide de se modifier. Si le glissement est facile, le liquide est
fluide et la viscosité est faible. Au contraire la viscosité
peut être très élevée, le liquide ressemble
à un solide mou. La viscosité est très sensible à
la température.
Le solide amorphe
Le cas typique est celui du verre qui, à température ordinaire,
a l'apparence d'un solide très dur et indéformable. Lorsqu'on
augmente la température, il fond sans qu'il y ait discontinuité
dans les propriétés physiques (transition progressive), c'est
à dire sans qu'il y ait de changement dans la structure atomique.
C'est un cas rare de solide appelé solide amorphe ou
vitreux
où l'état solide est en fait un état liquide (donc
une structure désordonnée) de viscosité très
élevée.
3.2. L'état ordonné : le solide cristallisé
Pour l'immense majorité des corps purs, la transition solide-liquide
est discontinue et se produit à température fixe pour une
pression déterminée : suivant le sens, elle est appelée
fusion
ou solidification.
Il existe aussi une transition discontinue solide-gaz : suivant le
sens, c'est la sublimation ou la condensation.
Les solides (à l’exception des solides amorphes) ont des structures
ordonnées. On parle de solide cristallisé avec
des maillages périodiques, des " empilements " réguliers.
C’est le domaine de la cristallographie.
On distingue quatre types de solides cristallisés :
- les solides métalliques constitués d’ions positifs
simples (atomes ayant perdu 1 ou 2 électrons périphériques)
baignant dans un " gaz " d’électrons libres ou quasi-libres,
- les solides ioniques constitués d’ions positifs et négatifs,
- les solides covalents qui sont isolants si la bande d’énergie
interdite est large et semi-conducteurs si elle est moindre,
- les solides moléculaires où les interactions de type
Van der Waals expliquent la cohésion.
L’énergie d’un solide est constituée de la somme des
énergies de vibration (autour de leur position d’équilibre)
des particules de base (ions, atomes ou molécules) et de la somme
des énergies internes des particules de base.
Si la particule de base est un atome ou un ion simple, on obtient, pour des
températures suffisantes, 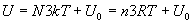 .
.
Ce résultat est connu sous le nom de loi de Dulong et Petit
Remarque : entre ordre et désordre
Dans un souci de clarté, nous avons distingué l'état
ordonné et l'état désordonné.
En fait, la situation est parfois plus complexe et on parle de structures
mal
cristallisées ou douées d'un ordre cristallin partiel
: dans cette catégorie, on range les hauts polymères (plastiques),
beaucoup de substances essentielles à la constitution de nos organes
et les cristaux liquides.
Annexe : la loi de distribution des
vitesses de Maxwell
1. Fonction de distribution du vecteur vitesse
Pour un gaz en état d’équilibre, posons la question suivante
:
Quelle probabilité existe qu’une molécule ait ses composantes
de vitesse comprise entre vx et
vx+dvx
, vy et vy+dvy
, vz et vz+dvz
(repère cartésien habituel) ?
Cette probabilité d3P dépend
de 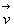 (c’est à
dire vx , vy
, vz ) et de dvx
, dvy , dvz
. Elle ne dépend pas de la position de la molécule puisque le
gaz est en équilibre.
(c’est à
dire vx , vy
, vz ) et de dvx
, dvy , dvz
. Elle ne dépend pas de la position de la molécule puisque le
gaz est en équilibre.
Nous postulons que d3P
est proportionnelle à chacun des intervalles dvx
, dvy , dvz
.
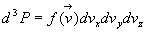
Il n’y a pas de direction privilégiée. Nous pouvons faire
une rotation circulaire des axes cartésiens, la probabilité
sera inchangée (isotropie de l’espace).
La fonction 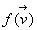 ne
dépend pas du vecteur
ne
dépend pas du vecteur 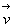 ,
au mieux elle dépend de l’intensité de vitesse v.
,
au mieux elle dépend de l’intensité de vitesse v.
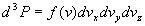
Soit dPx la probabilité
pour une molécule d’avoir sa composante suivant l’axe Ox comprise
entre vx et vx+dvx
.
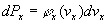 de même
de même 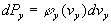 et
et 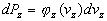
L’isotropie de l’espace impose 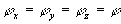
La loi des probabilités composées implique :
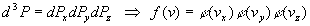
Déterminer les fonctions f et jrelève
de la méthodologie mathématique suivante :

avec 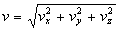
En réorganisant, on obtient : 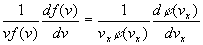
Le membre de gauche dépend de v c’est à dire de
vx
, vy , vz
, celui de droite uniquement de vx
. Le résultat ne peut être qu’une constante que nous notons
a
.
Il suit que : 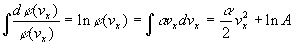
Soit,  et
des expressions identiques pour
et
des expressions identiques pour  .
.
Alors 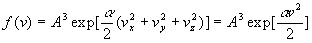
Remarquons que a est nécessairement
négatif sinon la probabilité pour une molécule d’avoir
une composante de vitesse infinie serait infinie ce qui voudrait dire que
toutes les molécules seraient à vitesse infinie et que l’énergie
serait infinie !!!
Nous posons a / 2 =-B avec B >
0.
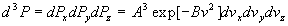
La condition de normalisation
La probabilité pour une molécule d’avoir une composante de vitesse
comprise entre -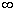 et +
et +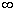 ou une intensité
de vitesse comprise entre 0 et +
ou une intensité
de vitesse comprise entre 0 et +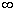 est égale à 1 (100% de chances).
est égale à 1 (100% de chances).
Ainsi, par exemple,
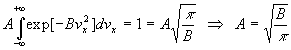
Remarque
Nous avons parlé en terme de probabilité. Un langage équivalent
consiste à chercher, dans une enceinte contenant N molécules,
le nombre dN de molécules ayant certaines caractéristiques,
à savoir par exemple, le nombre de molécules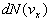 ayant
une composante de vitesse comprise entre vx et vx+dvx
.
ayant
une composante de vitesse comprise entre vx et vx+dvx
.
Ce nombre est égal à : 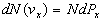
2. Fonction de distribution du module de vitesse
Quelle est la probabilité dP(v) pour une molécule
d’avoir une intensité de vitesse comprise entre v et
v+dv
? ou combien y a t’il de molécules dN(v) dans une enceinte
contenant N molécules ayant une intensité de vitesse
comprise entre v et v+dv ?
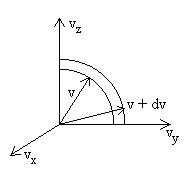
Pour répondre à cette question, nous nous plaçons
dans l’espace des vitesses c’est à dire un repère
cartésien de coordonnées Ovx
, Ovy , Ovz
.
 |
Les composantes vx
, vy , vz
ne sont pas indépendantes puisque liées par la relation 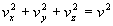 .
.
L’extrémité des vecteurs vitesse 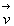 ayant une intensité de vitesse v, c’est à dire des
composantes de vitesse liée par la relation ci-dessus, se trouve
dans l’espace des vitesses sur la sphère de rayon v. Il en
sera de même pour l’extrémité des vecteurs vitesse ayant
une intensité v + dv.
ayant une intensité de vitesse v, c’est à dire des
composantes de vitesse liée par la relation ci-dessus, se trouve
dans l’espace des vitesses sur la sphère de rayon v. Il en
sera de même pour l’extrémité des vecteurs vitesse ayant
une intensité v + dv. |
Dans l’espace des vitesses, nous délimitons une portion d’espace comprise
entre la sphère de rayon v + dv et la sphère de rayon v,
de volume égale à 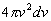 .
.
La probabilité d3P est proportionnelle
à  c’est
à dire au volume élémentaire dans l’espace de vitesse.
Pour obtenir dP(v), nous devons intégrer d3P
à tous les vecteurs vitesse possibles c’est à dire ayant leur
extrémité entre les deux sphères.
c’est
à dire au volume élémentaire dans l’espace de vitesse.
Pour obtenir dP(v), nous devons intégrer d3P
à tous les vecteurs vitesse possibles c’est à dire ayant leur
extrémité entre les deux sphères.
Cette intégration est particulièrement simple puisque
l’intensité v de la vitesse dans cette espace est constante.
On obtient donc : 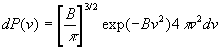 et
aussi, dans une enceinte contenant N molécules, le nombre de molécules
dN(v) ayant un module de vitesse compris entre v et v + dv
: dN(v) = N dP(v).
et
aussi, dans une enceinte contenant N molécules, le nombre de molécules
dN(v) ayant un module de vitesse compris entre v et v + dv
: dN(v) = N dP(v).
3. Calcul d’une valeur moyenne
La valeur moyenne <G> d’une grandeur G est le produit
de G multipliée (pondérée) par la probabilité
d’obtenir G intégré à toutes les valeurs possibles
de cette grandeur.
Ainsi, par exemple
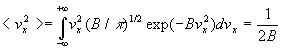
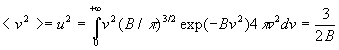
Remarque : 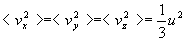
4. Retour sur la loi de distribution des vitesses
La mesure, pour un gaz parfait monoatomique, de la capacité calorifique
à volume constant, conduit à :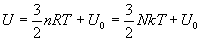
Si nous formulons l’hypothèse que la partie de l’énergie
liée à la température est due à l’agitation
cinétique des molécules, nous pouvons écrire :
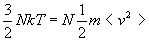 ð
ð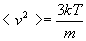
Nous disposons de deux expressions de la vitesse quadratique moyenne.
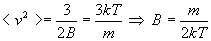
Les expressions de distribution des vitesses deviennent :
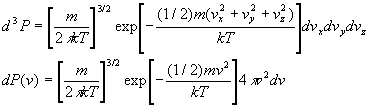
5. Pression d’un gaz parfait
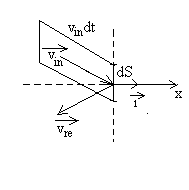
Nous considérons le choc des molécules sur un élément
de paroi dS que nous prenons arbitrairement perpendiculaire à
l’axe Ox. Le gaz étant en état d’équilibre,
toutes les directions sont équivalentes.
 |
Soient 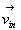 la
vitesse incidente d’une molécule frappant l’élément
de paroi et la
vitesse incidente d’une molécule frappant l’élément
de paroi et 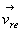 sa vitesse après le choc.
sa vitesse après le choc.
Le choc est élastique, la variation de quantité de mouvement
pour cette molécule sera  si
si  est
la composante de est
la composante de 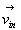 suivant
la direction Ox. La quantité de mouvement transmise à
la paroi sera : suivant
la direction Ox. La quantité de mouvement transmise à
la paroi sera :  . . |
Combien de molécules de vecteur vitesse 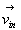 frappent la paroi dS pendant un temps dt ?
frappent la paroi dS pendant un temps dt ?
Elles sont contenues dans un cylindre de base dS, de génératrice
parallèle à 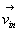 de
longueur
de
longueur 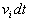 .
Le volume de ce cylindre est égal à
.
Le volume de ce cylindre est égal à 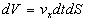 .
.
Le nombre de molécules sera 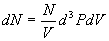 si N est le nombre de molécules contenues dans l’enceinte de volume
V.
si N est le nombre de molécules contenues dans l’enceinte de volume
V.
La quantité de mouvement transmise à la paroi par ces molécules
est 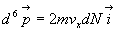 que
nous devons intégrer à toutes les molécules venant frapper
la paroi.
que
nous devons intégrer à toutes les molécules venant frapper
la paroi.
Soit 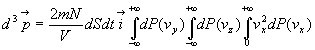
Les deux premières intégrales sont égales à 1,
la troisième à 
En appliquant le principe fondamental de la dynamique, on obtient la
pression à partir de
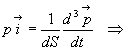
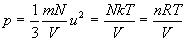
Retrouver l’équation d’état des gaz parfaits prouve la validité
et la cohérence des hypothèses formulées.
6. Le facteur de Boltzmann
Nous avons introduit la notion de degré de liberté (possibilité
d’énergie indépendante) et avons trouvé que, dans le cas
du mouvement de translation suivant un axe, par exemple Ox, le nombre
de molécules  ayant une composante de vitesse vx est
proportionnel à
ayant une composante de vitesse vx est
proportionnel à 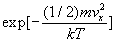 .
.
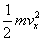 représente
l’énergie E suivant ce degré de liberté.
représente
l’énergie E suivant ce degré de liberté.
Nous généralisons ce résultat en admettant que le terme 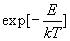 ,
appelé facteur de Boltzmann, caractérise la probabilité
d’occupation du niveau d’énergie E dans une situation d’équilibre
thermique à la température T.
,
appelé facteur de Boltzmann, caractérise la probabilité
d’occupation du niveau d’énergie E dans une situation d’équilibre
thermique à la température T.
Remarques :
- L’étude de l’équilibre de l’atmosphère terrestre supposé
isotherme a conduit au résultat 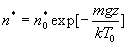 .
Nous trouvons là une application simple du facteur de Boltzmann.
.
Nous trouvons là une application simple du facteur de Boltzmann.
- La généralisation du résultat n’est acceptable
que pour des degrés de liberté indépendants.
En effet, pour la fonction distribution du module de vitesse, nous avons trouvé 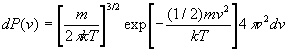 .
.
Ecrite en terme d’énergie, l’expression ci-dessus devient  et la probabilité est proportionnelle à
et la probabilité est proportionnelle à 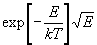 et non au facteur de Boltzmann.
et non au facteur de Boltzmann.
En fait 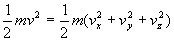 : les trois degrés de liberté affectés à chaque
translation ne sont pas indépendants.
: les trois degrés de liberté affectés à chaque
translation ne sont pas indépendants.
Remarque : Certains trouveront désuet,
dépassé ce cours sur la loi de distribution des vitesses
de Maxwell (appelé aussi Théorie cinétique des gaz
parfaits), pire réducteur dans la formation d’un étudiant
puisqu’il ne met pas en évidence qu’au sens quantique, la Physique
est probabiliste par essence.
Le raisonnement probabiliste de Maxwell est induit par l’ignorance
(ou l’incapacité) à connaître pour un très grand
nombre de particules leur position et leur vitesse à chaque instant.
Ce raisonnement ne remet pas en cause le déterminisme en Physique
à savoir, à chaque instant, chaque particule possède
une position et une quantité de mouvement fixées.
La mécanique quantique et l’inégalité de Heisenberg
infirment la possibilité de connaissance exacte de la position et
de la quantité de mouvement d’une particule –on doit introduire
la notion d’occupation d’une case de dimension finie dans l’espace de phase
et de saut pour passer d’une case à une autre. Le raisonnement probabiliste
devient incontournable et la Physique est probabiliste par essence.
Cette nouvelle façon d’appréhender la Physique s’est
développée à partir du début du 20ème
siècle, nous la croyons trop récente pour être enseignée
trop vite à des étudiants qui ne maîtrisent pas suffisamment
de connaissances en Physique …d’autant que notre sens commun, au niveau
macroscopique, est essentiellement déterministe.
Intégrales 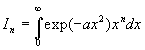 avec
avec 
Nous intégrons par parties en posant 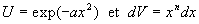
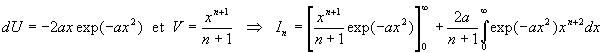
Nous obtenons une relation de récurrence 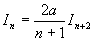
A ce stade, nous devons calculer I1
et I0 .
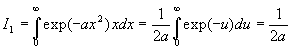
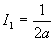
Le calcul de I0 est plus complexe.
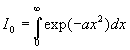 et
et 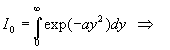
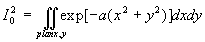
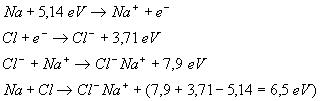




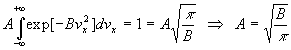

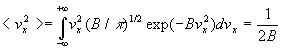
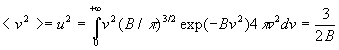
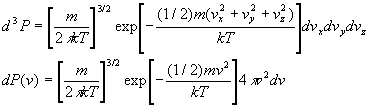

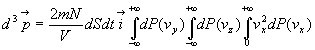
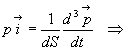
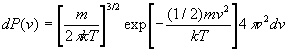 .
.
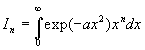 avec
avec 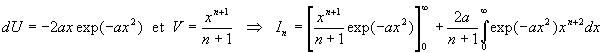
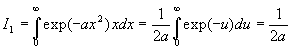
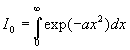 et
et