B1 , de volume
B2 , de volume
1) Dans tout l’exercice, les deux gaz seront considérés comme parfaits. Expliquer ce propos.
Exercices sur les équations d'état
1 - Soient deux ballons B1 et B2
.
B1 , de volume ![]() , contient du dioxyde de carbone sous la pression
, contient du dioxyde de carbone sous la pression ![]() .
.
B2 , de volume ![]() , contient du dioxygène sous la pression
, contient du dioxygène sous la pression ![]() .
.
1) Dans tout l’exercice, les deux gaz seront considérés comme
parfaits. Expliquer ce propos.
La température est ![]() . On relie B1 et B2
par un tube très fin.
. On relie B1 et B2
par un tube très fin.
2) L’équilibre étant établi, la température étant
toujours 0 °C , calculer les pressions partielles ![]() de dioxyde de carbone et
de dioxyde de carbone et ![]() de dioxygène dans le mélange.
de dioxygène dans le mélange.
3) Quelle est la pression totale ![]() et quelle est la masse volumique
et quelle est la masse volumique ![]() du mélange ?
du mélange ?
4) On porte la température de l’ensemble de 0 °C à
15 °C . La dilatation des ballons étant négligeable,
que deviennent la pression totale et la masse volumique du mélange ?
Application numérique : ![]()
| Méthodologie | Réponse 1 | Réponse 2 | Réponse 3 | Réponse 4 |
2 - La température de Mariotte est la température
pour laquelle le comportement d’un gaz réel se rapproche au mieux du
comportement du " gaz parfait ".
L’équation d’état d’un gaz parfait s’écrit ![]() .
On calcule la température de Mariotte en développant, à
partir de l’équation d’état du gaz réel considéré,
la quantité
.
On calcule la température de Mariotte en développant, à
partir de l’équation d’état du gaz réel considéré,
la quantité ![]() suivant les puissances croissantes de
suivant les puissances croissantes de ![]() .
.
Trouver la température de Mariotte pour :
- l’équation d’état de Van der Waals ![]()
- celle de Berthelot ![]()
- celle de Diétérici ![]()
| Méthodologie | Réponse 1 | Réponse 2 | Réponse 3 |
------------------------------------------------------------------------------------------
Méthodologie commune aux exercices ci-après
3 - Coefficients thermoélastiques
Calculer les coefficients thermoélastiques :
![]() coefficient de
dilatation à pression constante
coefficient de
dilatation à pression constante
![]() coefficient d’augmentation
de pression à volume constant
coefficient d’augmentation
de pression à volume constant
![]() coefficient
de compressibilité isotherme
coefficient
de compressibilité isotherme
1) pour le gaz parfait
2) pour le gaz d’équation d’état ![]()
3) pour le gaz de Van der Waals d’équation d’état ![]()
| Réponse 1 | Réponse 2 | Réponse 3 |
4 - Pression p, température T et volume V
représentent les variables d’état du système étudié.
Elles sont reliées par une équation d’état ![]() .
.
1) Trouver la relation liant les coefficients thermoélastiques, c’est
à dire le coefficient de dilatation à pression constante ![]() ,
le coefficient d’augmentation de pression à volume constant
,
le coefficient d’augmentation de pression à volume constant ![]() et le coefficient de compressibilité isotherme
et le coefficient de compressibilité isotherme ![]()
2) Calculer l’accroissement de pression subi par une masse donnée de
mercure lorsqu’on la chauffe de 0 °C à 1 °C à volume
constant en supposant ![]() indépendant de T.
indépendant de T.
Application numérique : ![]()
3) Montrer que la température du maximum de densité de l’eau sous
pression donnée est celle pour laquelle ![]()
| Réponse 1) | Réponse 2) | Réponse 3) |
5 - Soit un fil élastique de longueur " au
repos " ![]() à la température
à la température ![]() .
Lorsqu’on exerce sur ce fil une traction F, l’expérience montre
que la longueur change et devient L et que la température T
varie.
.
Lorsqu’on exerce sur ce fil une traction F, l’expérience montre
que la longueur change et devient L et que la température T
varie.
1) Justifier la relation ![]() .
.
2) On définit le coefficient de dilatation linéaire à force
constante par ![]() et le module d’Young par
et le module d’Young par ![]() où s est la section du fil.
où s est la section du fil.
Exprimer ![]() et dF.
et dF.
3) Pour la substance parfaitement élastique constituant le fil, l’équation
d’état s’écrit 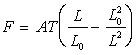 où
A est une constante.
où
A est une constante.
Calculer E et ![]() (valeur
de E à traction nulle).
(valeur
de E à traction nulle).
Calculer ![]() et
et ![]() (valeur de
(valeur de![]() à
traction nulle)
à
traction nulle)
| Réponse 1) | Réponse 2) | Réponse 3) |
6 - Le coefficient de dilatation à pression constante
d’une substance est ![]() ;
son coefficient de compressibilité isotherme est
;
son coefficient de compressibilité isotherme est ![]() où a et b sont des constantes.
où a et b sont des constantes.
Trouver l’équation d’état ![]() de la substance.
de la substance.
| Réponse |
7 - Un gaz obéit à l’équation de
Van der Waals ![]()
1) Calculer son coefficient de compressibilité isotherme ![]() ,
son coefficient de dilatation à pression constante
,
son coefficient de dilatation à pression constante ![]() et son coefficient d’augmentation de pression à volume constant
et son coefficient d’augmentation de pression à volume constant![]() .
.
2) Des mesures ont montré que, pour un gaz réel, les coefficients
de dilatation à pression constante et de compressibilité isotherme
peuvent s’écrire :
![]() ;
; ![]()
où A et B sont des constantes. En déduire l’équation d’état. Comparer à celle de Van der Waals.
| Réponse 1) | Réponse 2) |